题目内容
17.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.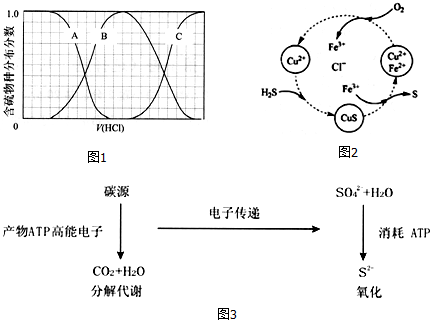
(1)已知:重晶石(BaS04)高温煅烧可发生一系列反应,其中部分反应如下:
BaS04(s)+4C(s)═BaS(s)+4C0(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:2C(s)+02(g)═2CO(g)△H=-221kJ•mol-1
则:Ba(s)+S(s)+202(g)═BaS04(s)△H=-1473.2KJ•mol-1.
(2)雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HN03有如下反应:
As2S3+10H++10NO3-═2H3AsO4+3S+10NO2↑+2H2O
当反应中转移电子的数目为2mol时,生成H3As04的物质的量为0.4mol.
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图1所示(忽略滴加过程H2S气体的逸出).
含硫物种B表示HS-.在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为c(填字母).
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
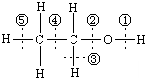
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示.
①在图示的转化中,化合价变化的元素是O、Fe、S.
②反应中若消耗1molO2时,保持溶液中Fe3+的物质的量不变,则转化成S的H2S的物质的量为2mol.
(5)在油田大量产出的污水中,硫化物主要是以水中的S042-被硫酸盐还原菌(SRB)还原产生的S2-形式存在,其反应机理如图3,请写出以甲烷为碳源时,S042-在SRB作用下还原为S2-的离子反应方程式CH4+SO42-$\frac{\underline{\;SRB\;}}{\;}$S2-+CO2+2H2O.
分析 (1)已知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s),据此计算.
(2)反应中As、S元素化合价升高,N原子化合价降低,根据N元素变化变化计算二氧化氮的物质的量,在结合方程式计算生成H3AsO4的物质的量;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,NaHS的含量先增加后减少,最后转化为H2S;
开始溶液中c(Na2S)=c(NaOH),滴加过程中S元素存在形式有:H2S、HS-、S2-,根据物料守恒可知c(Na+)=3c(S原子);
(4)①硫化氢与铜离子反应得到CuS与氢离子,氧气将亚铁离子氧化铁为铁离子,铁离子将CuS氧化得到S;
②反应中若消耗1molO2时,保持溶液中Fe3+的物质的量不变,整个过程相当于氧气将H2S氧化为S,同时生成水,根据电子转移守恒计算H2S的物质的量;
(5)由图中转化可知,甲烷与SO42-在SRB作用下还原为S2-的离子,同时生成二氧化碳与水,配平书写.
解答 解:(1)已知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=(-221)×2-(+460)-(+571.2)=-1473.2KJ•mol-1,
故答案为:-1473.2KJ•mol-1;
(2)反应中As、S元素化合价升高,N原子化合价降低,由+5价降低为+4,故转移电子的数目为2mol时,生成二氧化氮为$\frac{2mol}{5-4}$=2mol,由方程式:As2S3+10H++10NO3-═2H3AsO4+3S+10NO2↑+2H2O,可知生成H3As04的物质的量为2mol×$\frac{2}{10}$=0.4mol,
故答案为:0.4mol;
(3)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,NaHS的含量先增加后减少,最后转化为H2S,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,C浓度一直在增加为H2S,故B表示HS-;
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],故c正确;
故答案为:HS-;c;
(4)①硫化氢与铜离子反应得到CuS与氢离子,氧气将亚铁离子氧化铁为铁离子,铁离子将CuS氧化得到S,图中O元素、Fe元素、S元素化合价发生变化,
故答案为:O、Fe、S;
②反应中若消耗1molO2时,保持溶液中Fe3+的物质的量不变,整个过程相当于氧气将H2S氧化为S,同时生成水,根据电子转移守恒,转化为S的H2S的物质的量为$\frac{1mol×4}{2}$=2mol,
故答案为:2mol;
(5)由图中转化可知,甲烷与SO42-在SRB作用下还原为S2-的离子,同时生成二氧化碳与水,反应离子方程式为:CH4+SO42-$\frac{\underline{\;SRB\;}}{\;}$S2-+CO2+2H2O,
故答案为:CH4+SO42-$\frac{\underline{\;SRB\;}}{\;}$S2-+CO2+2H2O.
点评 本题属于拼合型题目,涉及反应热计算、氧化还原反应及有关计算、盐类水解等,侧重考查学生分析解决问题能力,需要学生具备扎实的基础,难度中等.

| A. | 硫黄 | B. | 硫酸钠 | C. | 酒精 | D. | 硝酸钾溶液 |
| A. | 尼古丁 | B. | CO2 | C. | H2S | D. | NH3 |
| A. | 水果、蔬菜含有丰富的维生素,若要减肥,每天只吃水果、蔬菜即可 | |
| B. | 米饭含有大量的淀粉,成人每天食用量不能超过500g | |
| C. | 要促进身体健康,饮食必须合理搭配 | |
| D. | 鸡蛋含有丰富的蛋白质,人体所需的蛋白质可由鸡蛋提供,青少年可适当多吃 |
| A. | 3M(气)+2N(气)?P(气)+4Q(气) | B. | M(气)+2N(气)?3P(气)+Q(固) | ||
| C. | M(气)+N(气)?P(气) | D. | 以上都达到平衡 |
| A. | 0.6mol H2O2 | B. | 0.5mol H2SO4 | C. | 1mol HNO3 | D. | 1.5mol He |
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3•H2O分子数为0.1 NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2 NA | |
| C. | 标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2 NA | |
| D. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1 NA |
 图为乙醇分子的化学键示意图,请按要求回答问题:
图为乙醇分子的化学键示意图,请按要求回答问题: (1)可正确表示原子轨道的是:AC.
(1)可正确表示原子轨道的是:AC.