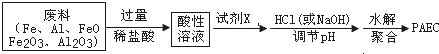
题目内容
6.四川省钙芒硝矿(主要成分CaSO4•Na2SO4)资源丰富.钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),其简要生产流程如图1所示.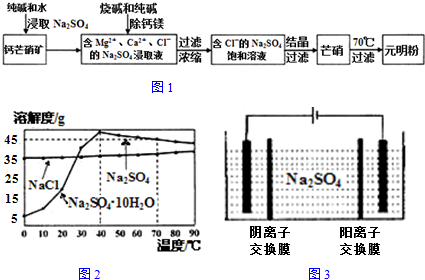
请回答下列问题:
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取.CaSO4能转化为CaCO3的原因是碳酸钙溶解度小于硫酸钙
(2)向Na2SO4的浸取液中加入适量烧碱和纯碱,Ca2+和Mg2+分别生成CaCO3、Mg(OH)2(填写化学式)被过滤除去.
(3)根据如图2溶解度曲线,可采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是:
40°C内,Na2SO4•10H2O的溶解度随温度的降低显著减小,而NaCl的溶解度基本不变,冷却时只有Na2SO4•10H2O结晶析出
(4)已知:25℃、101kPa时,2C(s)+O2(g)=2CO(g)△H=-222kJ/mol
4Na2SO3(s)=3Na2SO4(s)+Na2S(s)△H=-122kJ/mol
2Na2SO3 (s)+O2(g)=2Na2SO4(s)△H=-572kJ/mol
元明粉经碳还原制备Na2S的热化学方程式是Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)△=+578KJ/mol
(5)如图3,用惰性电极电解Na2SO4溶液,阳极区制得H2SO4溶液,阴极区制得NaOH溶液.其电解总反应的化学方程式是2Na2SO4+6H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+4NaOH+2H2↑+O2↑.
(6)芒硝加热至70℃时,得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4.若3220kg芒硝加热到70℃时,可析出元明粉(Na2SO4)的质量是610Kg.
分析 芒硝矿(主要成分CaSO4•Na2SO4)资源丰富.钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),芒硝矿加入碳酸钠溶液浸取Na2SO4时,利用碳酸钙溶解度小于硫酸钙,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,得到滤液含有Mg2+,Ca2+,Cl-,加入烧碱沉淀镁离子,加入碳酸钠除去钙离子过滤浓缩得到含氯离子的硫酸钠溶液,浓缩结晶过滤得到芒硝,70°C加热得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4;
(1)碳酸钙比硫酸钙难溶,加入碳酸钠溶液使CaSO4能转化为CaCO3;
(2)加入碳酸钠溶液沉淀钙离子生成碳酸钙沉淀,加入氢氧化钠沉淀镁离子生成氢氧化镁沉淀;
(3)图象分析可知40°C内,Na2SO4•10H2O的溶解度随温度的降低显著减小,而NaCl的溶解度基本不变;
(4)依据热化学方程式和盖斯定律计算所得热化学方程式;
(5)用惰性电极电解Na2SO4溶液,阳极区是氢氧根离子失电子生成氧气,氢离子浓度增大制得H2SO4溶液,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大制得NaOH溶液;
(6)70℃时硫酸钠溶解度为45g,计算3220kg芒硝中结晶水的质量和硫酸钠质量,结合溶解度计算溶解的硫酸钠质量,得到元明粉(Na2SO4)的质量;
解答 解:芒硝矿(主要成分CaSO4•Na2SO4)资源丰富.钙芒硝矿可生产具有广泛用途的芒硝(Na2SO4•10H2O)和元明粉(Na2SO4),芒硝矿加入碳酸钠溶液浸取Na2SO4时,利用碳酸钙溶解度小于硫酸钙,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,得到滤液含有Mg2+,Ca2+,Cl-,加入烧碱沉淀镁离子,加入碳酸钠除去钙离子过滤浓缩得到含氯离子的硫酸钠溶液,浓缩结晶过滤得到芒硝,70°C加热得到Na2SO4的饱和溶液(结晶水作溶剂,忽略加热过程中水的蒸发)和无水Na2SO4;
(1)浸取Na2SO4时,加入少量Na2CO3可使钙芒硝矿中的部分CaSO4转化为CaCO3,破坏钙芒硝矿结构,从而促进Na2SO4的浸取.CaSO4能转化为CaCO3的原因是碳酸钙比硫酸钙难溶,加入碳酸钠溶液使CaSO4能转化为CaCO3,
故答案为:碳酸钙溶解度小于硫酸钙;
(2)加入碳酸钠溶液沉淀钙离子生成碳酸钙沉淀,化学式为CaCO3,加入氢氧化钠沉淀镁离子生成氢氧化镁沉淀化学式为Mg(OH)2,
故答案为:CaCO3;Mg(OH)2;
(3)采用冷却结晶法从含少量NaCl的Na2SO4饱和溶液中制得芒硝的原因是,图象分析可知40°C内,Na2SO4•10H2O的溶解度随温度的降低显著减小,而NaCl的溶解度基本不变,冷却时只有Na2SO4•10H2O结晶析出,
故答案为:40°C内,Na2SO4•10H2O的溶解度随温度的降低显著减小,而NaCl的溶解度基本不变,冷却时只有Na2SO4•10H2O结晶析出;
(4)依据热化学方程式和盖斯定律计算所得热化学方程式,
①2C(s)+O2(g)=2CO(g)△H=-222kJ/mol
②4Na2SO3(s)=3Na2SO4(s)+Na2S(s)△H=-122kJ/mol
③2Na2SO3 (s)+O2(g)=2Na2SO4(s)△H=-572kJ/mol
依据盖斯定律计算得到,(①-③)×2+②得到元明粉经碳还原制备Na2S的热化学方程式是:Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)△=+578KJ/mol,
故答案为:Na2SO4(s)+4C(s)=Na2S(s)+4CO(g)△=+578KJ/mol;
(5)用惰性电极电解Na2SO4溶液,阳极区是氢氧根离子失电子生成氧气,氢离子浓度增大制得H2SO4溶液,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大制得NaOH溶液,反应的化学方程式为:2Na2SO4+6H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+4NaOH+2H2↑+O2↑,
故答案为:2Na2SO4+6H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+4NaOH+2H2↑+O2↑;
(6)70℃时硫酸钠溶解度为45g,计算3220kg芒硝中结晶水的质量=3220Kg×$\frac{18×10}{322}$=1800kg,含有硫酸钠质量=3220kg-1800kg=1420kg,结合溶解度计算溶解的硫酸钠质量为x,
100g:45g=1800g:x
x=810kg
得到元明粉(Na2SO4)的质量=1420kg-810kg=610kg,
故答案为:610;
点评 本题考查了物质分离提纯的方法和流程分析判断,主要是实验操作和物质性质的理解应用,掌握题干信息和活性基础是关键,题目难度中等.

| A. | X与Y只能形成一种化合物 | |
| B. | 原子半径:r(Y)<r(W)<r(Z) | |
| C. | W的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z的最高价氧化物对应的水化物是酸 |
| A. | 水和四氯化碳 | B. | 碘和四氯化碳 | C. | 酒精和水 | D. | 汽油和植物油 |
| A. | CH2=CH2 | B. | HCOOCH3 | C. | CH3COOCH2CH2CH3 | D. | CH3 CH2CH2CH3 |

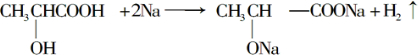 ;
; ;
;