题目内容
18.新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O.乙醛中碳原子的杂化轨道类型为sp3、sp2,1mol乙醛分子中含有的σ键的数目为6NA.乙酸的沸点明显高于乙醛,其主要原因是CH3COOH存在分子间氢键.Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个铜原子.分析 乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键;乙酸分子间可形成氢键导致沸点较高;根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目.
解答 解:乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛;该晶胞中O原子数为4×1+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个,
故答案为:sp3、sp2;6NA;CH3COOH存在分子间氢键;16.
点评 本题考查了氢键、杂化类型、晶胞的计算等,题目综合性强,侧重于基础知识的综合应用考查,题目难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
13.下列关于离子键的特征的叙述中,正确的是( )
| A. | 一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性 | |
| B. | 因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的 | |
| C. | 因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl- | |
| D. | 因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子 |
3.某微粒的结构示意图为 ,它表示( )
,它表示( )
 ,它表示( )
,它表示( )| A. | 氧原子 | B. | 氧离子 | C. | 氖原子 | D. | 钠离子 |
10.以下两反应达到平衡后分别加入少量H${\;}_{2}^{18}$O,重新达平衡时,含18O的物质分别是( )
①CO+H2O?CO2+H2 ②CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O.
①CO+H2O?CO2+H2 ②CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O.
| A. | 2种 3种 | B. | 3种 2种 | C. | 3种 4种 | D. | 2种 2种 |
8.关于元素周期表的叙述中,不正确的是( )
| A. | 俄国化学家门捷列夫编制了第一个元素周期表 | |
| B. | 元素周期律是由原子核外电子排布的周期性变化引起的 | |
| C. | 在元素周期表的过渡元素区域中寻找制催化剂的元素 | |
| D. | 元素周期表中最右上角元素的非金属性最强 |
9.下列说法不正确的是( )
| A. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 | |
| B. | 乙酸乙酯在H218O中水解,产物乙酸中将含有18O同位素 | |
| C. | 淀粉与稀硫酸混合加热一段时间后,滴加碘水溶液变蓝,说明淀粉没有水解 | |
| D. | Na2SO4•10H2O失水时吸热,结晶时放热,因而该晶体可作储热材料实现化学能与热能相互转化 |
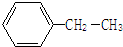 乙苯
乙苯 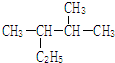 2,3-二甲基戊烷
2,3-二甲基戊烷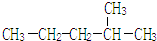 2-甲基戊烷
2-甲基戊烷 .
.