题目内容
13.下列关于离子键的特征的叙述中,正确的是( )| A. | 一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性 | |
| B. | 因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的 | |
| C. | 因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl- | |
| D. | 因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子 |
分析 A.离子键的特征是没有方向性和饱和性;
B.离子键没有方向性和饱和性,但阴阳离子的排列是有规律的;
C.氯化钠晶体中,每个钠离子周围吸引6个氯离子;
D.离子键没有方向性和饱和性,为了使物质能量最低、体系最稳定,一种离子周围不能吸引任意个带异性电荷的离子.
解答 解:A.离子键的特征是没有饱和性和方向性,所以离子键无方向性,则带异性电荷的离子间的相互作用与其所处的相对物质无关,故A正确;
B.离子键的特征是没有饱和性和方向性,所以离子键无方向性,则带异性电荷的离子间的相互作用与其所处的相对物质无关,但是,为了使物质的能量最低、体系最稳定,阴阳离子的排列还是有规律的,不是随意的,故B错误;
C.氯化钠晶体中,阴阳离子的配位数都是6,故C错误;
D.离子键的特征是没有饱和性和方向性,所以离子键无方向性,则带异性电荷的离子间的相互作用与其所处的相对物质无关,但是,为了使物质的能量最低、体系最稳定,阴阳离子的排列还是有规律的,不是随意的,因为这个数目要受到两种离子半径比和个数比的影响,故D错误;
故选A.
点评 本题考查离子键、离子晶体等知识点,明确离子键的形成条件及离子键特点是解本题关键,熟悉氯化钠、氯化铯晶体类型其配位数.

练习册系列答案
相关题目
4.在100mL含等物质的量HBr和H2SO3的溶液里通入标准状况224mlCl2,有一半Br-变为Br2.则反应后溶液中SO42-的浓度等于(假设反应前后溶液体积忽略不计)( )
| A. | 0.08mol/L | B. | 0.0018mol/L | C. | 0.075mol/L | D. | 0.0075mol/L |
8.以W为主要原料制备T的部分流程如下
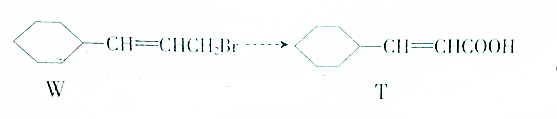
依次发生的有机反应所需要的试剂与条件从左至右依次为( )
①氯化氢,催化剂 ②氢氧化钠水溶液,加热
③氧气,催化剂 ④氢氧化钠醇溶液,加热,酸化.
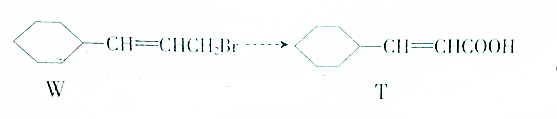
依次发生的有机反应所需要的试剂与条件从左至右依次为( )
①氯化氢,催化剂 ②氢氧化钠水溶液,加热
③氧气,催化剂 ④氢氧化钠醇溶液,加热,酸化.
| A. | ①③②④ | B. | ③①④② | C. | ②①③④ | D. | ①②③④ |
5.下列对铍及其化合物的叙述中,正确的是( )
| A. | 硼的原子半径大于铍的原子半径 | |
| B. | 氯化铍分子中铍原子的最外层电子数是8 | |
| C. | 氢氧化铍的碱性比氢氧化钙弱 | |
| D. | 单质铍跟冷水反应产生氢气 |
3.下列方程式正确的是( )
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 硫化钠溶液呈碱性的原因:S2-+2H2O=H2S+2OH- | |
| C. | 向碳酸钠溶液中通入少量的二氧化硫:2SO2+CO32-+H2O=2HSO3-+CO2↑ | |
| D. | 氧化亚铁溶于稀硝酸中:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 molCl2与足量Fe反应转移电子数一定为3NA | |
| B. | 1mol SiO2晶体中含NA个SiO2分子 | |
| C. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
 ;HCl.
;HCl.