题目内容
6.如图的曲线是800℃时,2L密闭容器中A、B、C三种气体物质的量随时间变化的情况,用B物质表示20min的平均反应速率大小为0.01mol/(L.min);能以此曲线表示的反应是2A?B+3C.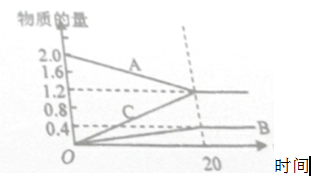
分析 根据v=$\frac{△c}{△t}$计算反应速率;根据曲线的变化趋势判断反应物和生成物,根据物质的量变化之比等于化学计量数之比书写方程式.
解答 解:反应开始至20min,B的平均反应速率为v=$\frac{\frac{0.4mol}{2L}}{20min}$=0.01mol/(L.min),由图象可以看出,A的物质的量逐渐减小,B、C的物质的量逐渐增大,则A为反应物,B、C为生成物,20min后,A的物质的量为定值且不为零,为可逆反应,相同时间内物质的量的变化比值为:△n(A):△n(B):△n(C)=(2.0-1.2)mol:0.4mol:1.2mol=2:1:3,则化学方程式为2A?B+3C,
故答案为:0.01mol/(L.min);2A?B+3C.
点评 本题考查化学平衡的变化图象,题目难度不大,本题注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.

练习册系列答案
相关题目
14.将甲乙两种有机物组成的混合物进行分离,已知甲乙的某些特征如下:
则应采取的分离方法是( )
| 物质 | 密度/(g•mL-1) | 沸点 | 水溶性 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7℃ | 溶 | 溶于甲 |
| A. | 蒸馏 | B. | 升华 | C. | 分液 | D. | 过滤 |
17.下列各组离子在水溶液中能发生反应的是( )
| A. | Ag+、Cl- | B. | H+、SO42- | C. | Na+、CO32- | D. | Ba2+、Cl- |

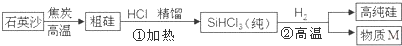

 ;HCl.
;HCl.