题目内容
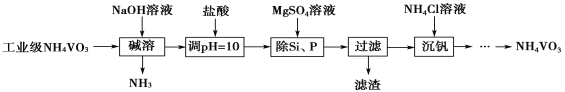
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
(1)碱溶时,下列措施有利于NH3逸出的是________(填字母序号)。
a.升高温度 b.增大压强 c.增大NaOH溶液的浓度
(2) ①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×10-5,若滤液中c(SiO32-)=0.08 mol·L-1,则c(Mg2+)=_____________。
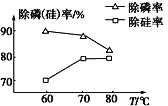
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除硅率升高,其原因是SiO32- +2H2O![]() H2SiO3↓+2OH-,但除磷率下降,其原因是_____________。
H2SiO3↓+2OH-,但除磷率下降,其原因是_____________。
(3)实验室过滤操作所需的玻璃仪器有_____________________。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10 mL一定浓度的滤液A和B,分别加入1 mL和10 mL的1 mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液的温度均为50 ℃、pH均为8,由专用仪器测定沉钒率,加入蒸馏水的目的是_________________________。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为 ____________。
【答案】ac 3×10-4mol/L Mg3(PO4)2溶解度增大和促进Mg2+水解生成Mg(OH)2 烧杯、漏斗、玻璃棒 9 使两份溶液总体积相等,确保其他条件相同,而NH4Cl的浓度不同 2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O
【解析】
以沉淀法除去工业级偏钒酸铵(NH4VO3)中硅、磷元素杂质的流程为:在偏钒酸铵中加氢氧化钠溶液,将偏钒酸铵溶解,铵盐遇到强碱生成氨气,再加盐酸调节溶液的pH值,加硫酸镁,生成Mg3(PO4)2、MgSiO3沉淀,过滤除去滤渣,在滤液中加氯化铵得偏钒酸铵。
(1)根据气体在水中溶解度的影响因素,利用平衡移动原理分析;
(2)①根据Ksp(MgSiO3)=c(Mg2+)·c(SiO32-),结合c(SiO32-)=0.08mol/L,进行计算;
②由于物质的溶解度随温度的升高而增大,并结合影响盐类水解的因素分析;
(3)根据过滤操作分析使用的玻璃仪器;
(4)探究NH4Cl的浓度对沉钒率的影响,对比实验应控制两溶液的体积相同;
(5)偏钒酸铵与草酸反应生成(NH4)2[(VO)2(C2O4)3]和CO2,据此解答。
(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,由于氨气在水中形成氨水能电离出氢氧根离子,根据平衡移动原理,增加OH-的浓度可以减小氨气的溶解度,故合理选项是ac;
(2)①已知Ksp(MgSiO3)=c(Mg2+)·c(SiO32-)=2.4×l0-5,结合c(SiO32-)=0.08mol/L,则c(Mg2+)=![]() mol/L=3×10-4mol/L;
mol/L=3×10-4mol/L;
②难溶性物质Mg3(PO4)2的溶解度随温度的升高而增大,且温度升高促进盐的水解,升温促进Mg2+水解生成Mg(OH)2沉淀,使硅酸根水解生成硅酸沉淀,反应的离子方程式为SiO32- +2H2O![]() H2SiO3↓+2OH-,因此导致除磷率降低,而除硅率升高;
H2SiO3↓+2OH-,因此导致除磷率降低,而除硅率升高;
(3)过滤是分离难溶性固体与可溶性液体混合物的操作,使用的玻璃仪器有烧杯、漏斗、玻璃棒;
(4)探究NH4Cl的浓度对沉钒率的影响,根据控制变量的原则,两溶液的体积必须相等,所以要向A中加入约9 mL蒸馏水,使两份溶液总体积相等,确保只有浓度是变量;
(5)偏钒酸铵与草酸反应生成(NH4)2[(VO)2(C2O4)3],V元素化合价降低,则碳元素化合价升高由H2C2O4中的+3价升高变为CO2中的+4价,根据原子守恒、电子守恒,可得反应的化学方程式为:2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O。

【题目】T ℃时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
达到平衡的时间/min | 5 | 8 | |
A的浓度/mol·L-1 | c1 | c2 | |
C的体积分数% | w1 | w3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A. 若n<4,则2c1<c2
B. 若n=4,则w3=w1
C. 无论n的值是多少均有2ρ1=ρ2
D. 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短


