题目内容
11. 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如上图所示已知当V1=160mL时,求金属粉末中Mg的物质的量以及V3为多少mL.
(该小问写出计算过程)
(2)若混合物仍为0.1mol,其中Mg粉的物质的量分数为a,用100mL 4mol/LHCl溶液溶解此混合物后,再加入450mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3.满足此条件的a的取值范围是:0.5≤a<1.
分析 (1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
由图可知,0~V1发生H++OH-=H2O,V1~A发生Mg2+、Al3+转化为沉淀的反应,A→B段发生Al(OH)3+OH-=AlO2-+2H2O,结合反应及原子守恒计算解答;
(2)若混合物仍为0.1mol,其中镁的物质的量分数为a,用400mL1mol•L-1盐酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,再结合n(Mg)+n(Al)=0.1mol判断a的范围.
解答 解:(1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为A时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液,再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
若V1=160mL,说明盐酸有剩余,剩余盐酸的物质的量=1mol/L×0.16L=0.16mol,则和金属反应的盐酸的物质的量=4mol/L×0.1L-0.16mol=0.24mol,
设镁的物质的量是x,铝的物质的量是y,x+y=0.1、2x+3y=0.24,解得:x=0.06mol,y=0.04mol,
V2时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.04mol+0.4mol=0.44mol,所以氢氧化钠的体积=$\frac{0.44mol}{1mol/L}$=440mL,
故答:金属粉末中Mg的物质的量为0.04,及V3为440;
(2)若混合物仍为0.1mol,其中镁的物质的量分数为a,用400mL1mol•L-1盐酸溶解后,再加入450mL 1mol•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400mL,再加入50mL 1mol•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1,
故答案为:0.5≤a<1.
点评 本题以图象形式考查混合物计算,题目难度中等,明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,注意守恒思想的运用,可以使计算简化.

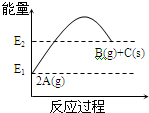
| A. | 1molC(s)的能量高于2molA(g)能量 | |
| B. | 该反应的热化学方程式为:2A(g)═B(g)+C(s)△H=(E1-E2)kJ/mol | |
| C. | 反应过程中当v(A)=0.4mol/(L•s),则v(C)=0.2mol/(L•s) | |
| D. | 该反应为吸热反应 |
| A. | 苯甲醇和甲基苯苯酚 | B. | 乙醇和乙醚 | ||
| C. | 丁二烯和2-丁烯 | D. | 乙醇和乙二醇 |
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
| A. | 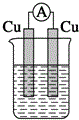 稀硫酸 | B. | 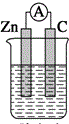 稀硫酸 | C. | 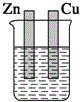 稀硫酸 | D. | 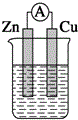 无水乙醇 |
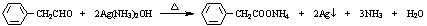 .
.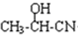 $→_{H_{2}O}^{HCI}$
$→_{H_{2}O}^{HCI}$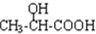 ,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色.
,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色. ;
;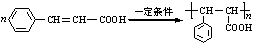 .
.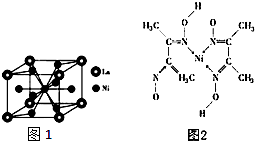 镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.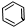 、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;