题目内容
6.某温度下,10L密闭容器中充入4mol A和6mol B(g).发生A(g)+2B(g)?C(g)+3D(g)反应,反应进行到10s时C的浓度为0.2mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.2倍.则(1)前10s以D(g)浓度变化表示的平均反应速率为多少?
(2)10s时,混合气体中D的体积分数为多少?
(3)平衡时,A的浓度是多少?
分析 (1)依据反应速率概念计算V(C)=$\frac{△c}{△t}$,反应速率之比等于化学方程式计量数之比得到D表示的反应速率;
(2)依据三段式列式计算得到10s时的气体物质的量,体积分数即为物质的量的分数=$\frac{D的物质的量}{气体总物质的量}$×100%;
(3)平衡时容器的压强是起始时的1.2倍,为气体物质的量的关系,设消耗A物质的量为x,化学平衡三段式列式得到
A(g)+2B(g)?C(g)+3D(g)
起始量(mol) 4 6 0 0
变化量(mol) x 2x x 3x
平衡量(mol)4-x 6-2x x 3x
浓度c=$\frac{n}{V}$计算得到.
解答 解:(1)V(C)=$\frac{△c}{△t}$=$\frac{0.2mol/L}{10s}$=0.02mol/L•s,反应速率之比等于化学方程式计量数之比得到D表示的反应速率v(D)=3v(C)=0.02mol/L•s×3=0.006mol/L•s,
答:前10s以D(g)浓度变化表示的平均反应速率为0.006mol/L•s;
(2)10s时C的浓度为0.2mol/L,物质的量为0.2mol/L×10L=2mol,
A(g)+2B(g)?C(g)+3D(g)
起始量(mol) 4 6 0 0
变化量(mol) 2 4 2 6
10s量(mol) 2 2 2 6
体积分数即为物质的量的分数=$\frac{D的物质的量}{气体总物质的量}$×100%=$\frac{6}{2+2+2+6}$×100%=50%,
答:10s时,混合气体中D的体积分数为50%;
(3)平衡时容器的压强是起始时的1.2倍,为气体物质的量的关系,设消耗A物质的量为x,
A(g)+2B(g)?C(g)+3D(g)
起始量(mol) 4 6 0 0
变化量(mol) x 2x x 3x
平衡量(mol)4-x 6-2x x 3x
4-x+6-2x+x+3x=(4+6)×1.2
x=2mol
浓度c=$\frac{n}{V}$=$\frac{(4-2)mol}{10L}$=0.2mol/L,
答:平衡时,A的浓度是0.2mol/L.
点评 本题考查了化学平衡的计算分析应用,主要是三段式列式计算方法和概念的理解应用,掌握基础是关键,题目难度中等.

| A. | 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 | |
| B. | 2p轨道上有2个未成对电子的原子和3p轨道上有2个未成对电子的原子 | |
| C. | 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 | |
| D. | 电子排布式为1s2的原子和外围电子排布式为2s22p6的原子 |
| A. | 用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜的要求 | |
| B. | 世博会期间,利用可降解的“玉米塑料”替代常用的一次性饭盒,可防止产生白色污染 | |
| C. | 蛋白质、淀粉、纤维素这些生活中的常见物质都是天然高分子化合物 | |
| D. | 煤经气化和液化两个物理过程,可变为清洁能源 |
| A. | 过氧化钠电子式:Na${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$Na | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: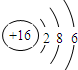 | |
| D. | 乙烯的结构简式:C2H4 |
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、CO32-、Cl- | ||
| C. | Na+、Ca2+、NO3-、CO32- | D. | Na+、K+、Cl-、SO42- |
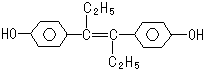
| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 1mol该有机物可以与5mol Br2发生反应 | |
| C. | 可分别与NaOH和NaHCO3发生反应 | |
| D. | 该有机物分子中,所有原子可能共平面 |
| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 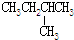 和 和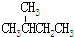 |
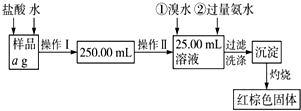 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题:
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题: 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答: