题目内容
7.氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )| A. | 直线 sp杂化 | B. | V型 sp杂化 | ||
| C. | 三角锥形 sp2杂化 | D. | 平面三角形 sp2杂化 |
分析 氮的最外层5个电子,最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,根据价层电子对互斥理论确定离子空间构型及中心原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数根据其价层电子对数.
解答 解:氮的最高价氧化物为N2O5,由两种离子构成,其中阴离子构型为平面正三角形,化学式应为NO3-,则其阳离子的化学式为:NO2+,其中心N原子价电子对数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(5-1-2×2)=2,所以其中的氮原子按sp方式杂化,阳离子的构型为直线型,
故选A.
点评 本题考查了杂化类型的判断和微粒的空间构型,题目难度中等,根据价层电子对互斥理论分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.能正确表示下列反应的离子方程式是( )
| A. | Cl2通入NaOH溶液:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液中加入稀HCl:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| C. | 实验室制取 Cl2:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H20 | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH${\;}_{4}^{+}$ |
18.在一定温度下,将等物质的量的CO和H2O(g)通入恒容密闭容器中,发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g),当正逆反应速率相等且不等于零时,下列说法不正确的是( )
CO(g)+H2O(g)?CO2(g)+H2(g),当正逆反应速率相等且不等于零时,下列说法不正确的是( )
| A. | 此时反应达到平衡 | B. | H2的浓度不再改变 | ||
| C. | 升温能使反应速率加快 | D. | CO和H2O完全转化 |
12.下列有关说法正确的是( )
| A. | 改变物质的性质一定要通过化学变化 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 一种元素可有多种离子,但只有一种原子 | |
| D. | 放热反应一定是不需加热就能发生的 |
19.Na2S2O3溶液跟稀H2SO4反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O.下列各组实验中,溶液中最先变浑浊的是( )
| 温度 | Na2S2O3溶液的体积和浓度 | H2SO4溶液的体积和浓度 | |
| A | 50℃ | 5mL 0.5mol•L-1 | 5mL 0.5mol•L-1 |
| B | 50℃ | 50mL 0.1mol•L-1 | 50mL 0.1mol•L-1 |
| C | 50℃ | 10mL 0.2mol•L-1 | 10mL 0.2mol•L-1 |
| D | 50℃ | 15mL 0.1mol•L-1 | 15mL 0.1mol•L-1 |
| A. | A | B. | B | C. | C | D. | D |
16.下列说法错误的是( )
| A. | 在共价化合物中一定含有共价键 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 非金属原子间只能形成共价化合物 |
17.下列离子方程式书写正确的是( )
| A. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-═2Fe2++S↓ | |
| B. | 碳酸钡中加入稀硫酸BaCO3+2H+═Ba2++CO2↑+H2O | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 碳酸氢钠溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
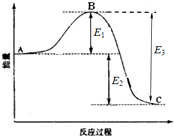 已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题:
已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题: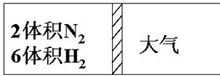 在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示.容器中发生以下反应:N2+3H2?2NH3(正反应为放热反应).若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题: