题目内容
15.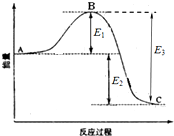 已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题:
已知1mol SO2(g)生成1mol SO3(g)的能量变化如图所示.回答下列问题:(1)图中A、C分别表示反应物总能量、生成物总能量.
(2)2SO2(g)+O2(g)═2SO3(g)△H=-2E2(用含“E1”、“E2”或“E3”的代数式表示).
(3)已知:在一定条件下,64g SO2气体氧化为SO3气体时放出99kJ的热量,请写出SO2氧化为SO3的热化学方程式SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1.
分析 (1)根据A、C分别表示反应物总能量的生成物总能量;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)根据64g SO2气体氧化为SO3气体时放出99kJ的热量来求.
解答 解:(1)因图中A、C分别表示反应物总能量、生成物总能量,故答案为:反应物总能量;生成物总能量;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-E2kJ•mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-2E2kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-2E2kJ•mol-1,故答案为:-2E2;
(3)因64g 即1molSO2气体氧化为SO3气体时放出99kJ的热量,则SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
所以SO2氧化为SO3的热化学方程式为SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
故答案为:SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1.
点评 本题主要考查了反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大.

练习册系列答案
相关题目
5.下列说法中错误的是( )
| A. | CCl4可由CH4制得,可用于萃取碘水中的碘 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和碳酸钠溶液鉴别 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 蒸馏装置中,温度计的水银球应插入到混合溶液中 |
10.按如图装置进行实验,若图B的X轴表示流入电极的电子的物质的量,则Y轴不可能表示的情况是( )


| A. | c (Ag+) | B. | 溶液的pH | C. | Ag棒的质量 | D. | c(NO3-) |
20.下列各组顺序的排列正确的是( )
| A. | 原子半径:Br<Cl<F | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | D. | 沸点:乙酸>乙醇>乙烷 |
7.氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
| A. | 直线 sp杂化 | B. | V型 sp杂化 | ||
| C. | 三角锥形 sp2杂化 | D. | 平面三角形 sp2杂化 |
5.想一想,NaOH固体,P2O5固体,无水CaCl2为什么可以归为一类?据此,与这三种物质可归为一类的是( )
| A. | 10%的H2SO4溶液 | B. | NaCl | ||
| C. | 碱石灰(固体,含NaOH,CaO) | D. | Ca(OH)2 |
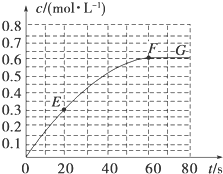 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=akJ•mol-1.其中B的物质的量浓度随时间变化如图所示.试回答下列问题.
298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)?2B(g)△H=akJ•mol-1.其中B的物质的量浓度随时间变化如图所示.试回答下列问题.