题目内容
【题目】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注。据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN)。
(1)白磷有毒能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4,该反应的氧化产物是 ,若有1 mol P4参加反应转移电子为 mol。
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka=6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1= 4.5×10-7、Ka2= 4.7×10-11,则向NaCN溶液通入少量CO2反应方程式是: 。
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是: 。
③电解法可以处理空气中的氮氧化物,用如右图示电解池,将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为 。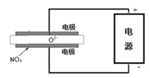
(3)①传统工业上利用氨气可以合成尿素。主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=" +72.49" kJ·mol-1
反应2NH3(g)+ CO2(g)= CO(NH2)2(s)+H2O(g)的△H= kJ·mol-1
②工业上用氨气制备硝酸,将一定质量的铜粉加入到100mL某浓度的稀硝酸中充分反应后,容器中剩余m1g铜粉,此时共收集到NO气体448mL(标准状况)。然后向上述混合物中加入稀硫酸至不再产生NO为止,容器剩余铜粉m2g,则m1-m2为 。
【答案】(1)H3PO4(1分);20(1分)
(2)①CO2+NaCN+H2O=NaHCO3+HCN(2分)
②NaCN+H2O2+H2O=NaHCO3+NH3↑(2分)
③2NOx+ 4xe-= N2+ 2xO2-(2分)
(3)①—86.98 (2分) ②5.04g(2分)
【解析】
试题(1)反应过程中磷的化合价升高,所以H3PO4是氧化产物,1 mol P4参加反应化合价升高5价,所以转移5×4=20mol电子。
(2)①因为HCN的电离平衡常数在H2CO3的两极电离平衡常数之间,故向 NaCN溶液通入少量CO2反应:CO2+NaCN+H2O=NaHCO3+HCN;②能使湿润的红色石蕊试纸变蓝色的气体,是氨气,故常氰化钠能与过氧化氢溶液反应方程式:NaCN+H2O2+H2O=NaHCO3+NH3↑;③电解池阴极发生还原反应,反应方程式:2NOx+ 4xe-= N2+ 2xO2-。
(3)①据盖斯定律①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H1=" -" 159.47 kJ·mol-1,②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=" +72.49" kJ·mol-1,③2NH3(g)+ CO2(g)= CO(NH2)(s)+H2O
(g)△H3,③=①+②,△H3="-159.47+72.49=-86.98" kJ·mol-1;②档容器中剩余m1 g铁粉,生成448mlNO,物质的量=0.448/22.4=0.02mol,转移电子0.02×3=0.06mol,铁由0价变为+2价,所以生成的二价铁0.06/2=0.03mol,对应的硝酸根是0.06mol,加入硫酸时氮元素全部转化为NO,转移电子0.06×3=0.18mol,继续溶解的铁是0.18/2=0.09mol,质量=0.09×56=5.04g,所以质量变化5.04g。

【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。
(2)若测定结果偏高,其原因可能是_____________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后又用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(3)判断滴定终点的现象是______________________。
(4)如图是某次滴定时的滴定管中的液面,其读数为________mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |