题目内容
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g)ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g)ΔH2=-23.5kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH3=-41.3kJ/mol.
已知:H-H的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol;
(2)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g)![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2molCH3OCH3、0.4molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.v正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,则混合液中c(CH3COO-)=______mol/L。
【答案】1072.7 0.01molL-1min-1 10000 C 不 1+10-8-10-6
【解析】
(1)①根据反应Ⅲ及△H=反应物的键能之和-生成物的键能之和列式计算;
(2)①根据三段式利用反应2CH3OCH3(g)+4CO(g)+H2(g)CH3COOCH=CH2(g)+2CH3COOH(g)计算出平衡时各物质的浓度,结合平衡常数的表达式分析解答;②可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断; ③氩气不影响各组分的浓度,根据参与反应的物质的浓度是否变化分析判断;
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,即c(H+)=10-8mol/L,根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Li+),列式计算。
(1)根据Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-41.3kJ/mol可知,△H=反应物的键能之和-生成物的键能之和,则C≡O的键能=(-41.3kJ/mol)+(2×803kJ/mol)+(436kJ/mol)-(2×464kJ/mol)=1072.7kJ/mol,故答案为:1072.7;
(2)①设转化的氢气的物质的量为x,则
2CH3OCH3(g)+4CO(g)+H2(g)CH3COOCH=CH2(g)+2CH3COOH(g),
起始(mol) 0.2 0.4 0.1 0 0
反应(mol) 2x 4x x x 2x
平衡(mol) 0.2-2x 0.4-4x 0.1-x x 2x
则 ![]() ×100%=10%,解得x=0.05mol,0~10min内用CO浓度变化表示的平均反应速率v(CO)=
×100%=10%,解得x=0.05mol,0~10min内用CO浓度变化表示的平均反应速率v(CO)= ![]() =0.01molL-1min-1;该温度下,该反应的平衡常数K=
=0.01molL-1min-1;该温度下,该反应的平衡常数K=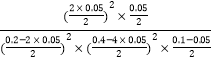 =10000,故答案为:0.01molL-1min-1;10000;
=10000,故答案为:0.01molL-1min-1;10000;
②A.v正(DME)=v逆(H2),不满足计量数关系,表明正逆反应速率不相等,该反应没有达到平衡状态,故A错误;B.该反应中气体总质量和体积始终不变,则混合气体的密度为定值,不能根据密度判断平衡状态,故B错误;C.该反应中气体总质量不变,而气体的物质的量为变量,当混合气体的平均相对分子质量不再变化时,表明该反应已经达到平衡状态,故C正确;D.c(CO)∶c(VAC)=4∶1,无法判断各组分的浓度是否继续变化,则无法判断平衡状态,故D错误;故答案为:C;
③保持温度不变,向反应釜中通入氩气增大压强,由于各组分的浓度不变,则化学平衡不移动,故答案为:不;
(3)常温下,将浓度均为2.0mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=8,即c(H+)=10-8mol/L,根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Li+),则c(CH3COO-)+10-6mol/L=10-8mol/L+![]() mol/L,整理可得c(CH3COO-)=1mol/L+10-8mol/L-10-6mol/L=(1+10-8-10-6)mol/L,故答案为:1+10-8-10-6。
mol/L,整理可得c(CH3COO-)=1mol/L+10-8mol/L-10-6mol/L=(1+10-8-10-6)mol/L,故答案为:1+10-8-10-6。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】有四种短周期元素,相关信息如下表。
元素 | 相关信息 |
A | 气态氢化物极易溶于水,可用作制冷剂 |
B | 单质的焰色反应为黄色 |
C | 单质是黄绿色气体,可用于自来水消毒 |
D | –2价阴离子的电子层结构与Ar原子相同 |
请根据表中信息回答:
(1)A在周期表中位于第______周期______族。
(2)用电子式表示B与C形成化合物的过程:______。
(3)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)______。
(4)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______。
a.其单质在常温下呈固态
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3
d.非金属性比C元素的强