题目内容
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。
(2)若测定结果偏高,其原因可能是_____________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后又用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(3)判断滴定终点的现象是______________________。
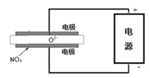
(4)如图是某次滴定时的滴定管中的液面,其读数为________mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
【答案】①ABCD滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不变色22.600.200 0或0.2
【解析】
(1) 碱式滴定管在装液前先用蒸馏水清洗,然后用待装液进行润洗;
(2)根据c(待测)= c(标准)×V(标准)/V(待测)分析不当操作对V(标准)的影响,以此判断;
(3)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据滴定管的结构与精确度为0.01 mL进行读数;
(5)先根据数据的有效性,然后求出平均消耗V(NaOH),接着根据c(待测)= c(标准)×V(标准)/V(待测)来计算。
(1)碱式滴定管在装液前应用待装液进行润洗,否则标准液的浓度偏小,①操作有误;因此本题答案是:①。
(2)A.配制标准溶液的固体NaOH中混有KOH杂质,标准溶液中氢氧根离子的浓度偏小,消耗的V(标准)增大,根据c(待测)= c(标准)×V(标准)/ V(待测)分析,测定结果偏高,所以A选项正确;
B.滴定终点读数时,仰视滴定管的刻度,消耗的V(标准)偏大, 根据c(待测)= c(标准)×V(标准)/V(待测)分析,测定结果偏高,故B正确;
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗,消耗的V(标准)变大, 根据c(待测)= c(标准)×V(标准)/V(待测)分析,测定结果偏大,故C正确;
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液,消耗的V(标准)偏大, 根据c(待测)= c(标准)×V(标准)/V(待测)分析,测定结果偏高,故D正确;
因此,本题正确答案是:ABCD。
(3)当滴入最后一滴NaOH溶液,溶液由无色变为粉红色,且半分钟内不褪色,即为终点;因此,本题正确答案是: 滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不变色。
(4)滴定管精确度为0.01mL,因此滴定管中的液面读数为22.60 mL;因此,本题正确答案是:22.60。
(5)三次滴定消耗的体积为:20.00mL,22.10 mL, 20.00mL, 22.10 mL误差太大,不能用;因此平均消耗V(NaOH)=20.00mL,根据c(待测)=c(标准)×V(标准)/V(待测) =0.2000×20.00/20.00=0.2000mol·L-1(或0.2mol·L-1);因此本题答案是:0.2000或0.2。

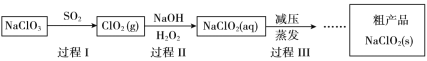
【题目】亚氯酸钠(NaClO2)是一种高效氧化、杀菌及漂白剂,其生产工艺如下:
(1)NaClO2中氯元素的化合价是_________。从氧化还原角度推测NaClO2可能具有的化学性质是_________。
(2)过程I常伴有少量Cl2生成。
① Cl2的存在会造成产品中含有NaCl,请结合离子方程式解释其原因_________。
② 结合下面信息,请设计实验方案除去ClO2中的Cl2 ________。
ClO2 | Cl2 | |
在水中的溶解性 | 易溶 | 溶 |
在CCl4中的溶解性 | 难溶 | 溶 |
(3)过程II中H2O2的作用是________(填“氧化剂”或“还原剂”)。
(4)理论上每生成1 mol NaClO2,消耗SO2的体积是________L(标准状况下)。
(5)已知:
i. 压强越大,物质的沸点越高。
ii. NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O
38~60℃时析出NaClO2晶体
高于60℃时分解成NaClO3和NaCl
① 过程III采用“减压蒸发”操作的原因是_____。
② 请将过程III的操作补充完整_______。