题目内容
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) ![]() COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=__________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =______。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。

X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体:2CO(g)+2NO(g)![]() 2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________________。
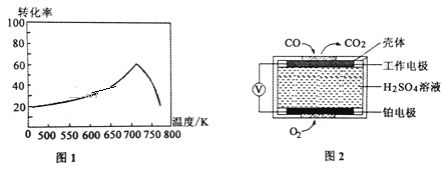
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式_______________。
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
【答案】 0.1 = 5 温度 < 温度升高到710K时,反应达到平衡状态,由于该反应是放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低 CO-2e-+H2O=CO2+2H+ 2NO+3H2O2=2NO3-+2H2O+2H+ c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
【解析】(1)①0~2min末△n(COCl2)=△n(CO)=1.2-0.8=0.4mol,△C(COCl2)=![]() =0.2mol/L,v(COCl2)=
=0.2mol/L,v(COCl2)=![]() =0.1mol/(Lmin); ②在2min~4min间,2min末△n(Cl2)=△n(CO)=0.4mol,剩余氯气等于0.2mol;到0.4min物质的量不变,所以达到平衡状态,所以v(Cl2)正=v(Cl2)逆;据以上分析,CO、氯气、COCl2剩余浓度分别是:
=0.1mol/(Lmin); ②在2min~4min间,2min末△n(Cl2)=△n(CO)=0.4mol,剩余氯气等于0.2mol;到0.4min物质的量不变,所以达到平衡状态,所以v(Cl2)正=v(Cl2)逆;据以上分析,CO、氯气、COCl2剩余浓度分别是: ![]() =0.4mol、
=0.4mol、![]() =0.1mol、
=0.1mol、![]() =0.2mol,K=
=0.2mol,K=![]() =5;③随X的升高CO的转化率降低,故X不是压强,故是温度;所以正方向是放热反应,a<0;(2)①温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;②一氧化碳在这极转变成二氧化碳,化合价升高,反应:CO-2e-+H2O=CO2+2H+;NO与H2O2溶液反应的离子方程式:2NO+3H2O2=2NO3-+2H2O+2H+;(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,发生的反应:2CH3OH+2KOH+3O2=K2CO3+H2O,0.5mol甲醇和0.8mol氢氧化钾反应,溶液中只剩余碳酸钾,所以浓度大小关系:C(K+)>C(CO32﹣)>C(HCO3﹣)>C(OH﹣)>C(H+)。
=5;③随X的升高CO的转化率降低,故X不是压强,故是温度;所以正方向是放热反应,a<0;(2)①温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;②一氧化碳在这极转变成二氧化碳,化合价升高,反应:CO-2e-+H2O=CO2+2H+;NO与H2O2溶液反应的离子方程式:2NO+3H2O2=2NO3-+2H2O+2H+;(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,发生的反应:2CH3OH+2KOH+3O2=K2CO3+H2O,0.5mol甲醇和0.8mol氢氧化钾反应,溶液中只剩余碳酸钾,所以浓度大小关系:C(K+)>C(CO32﹣)>C(HCO3﹣)>C(OH﹣)>C(H+)。


