题目内容
已知1—18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A.四种元素位于同一周期 | B.氢化物的稳定性H2Y>HZ |
| C.离子的氧化性aW3+ > bX+ | D.a+3=c﹣2 |
C
解析试题分析:元素的原子失去电子形成阳离子,电子层比原子少一层,是上一周期的惰性气体的原子结构;元素的原子获得电子形成阴离子,电子层结构是同一周期的惰性气体的原子结构。aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,所以四种元素位于两个不同的周期,选项A错误;Y、Z是同一周期的元素,由于非金属性:Z>Y,所以氢化物的稳定性HZ >H2Y,选项B错误;对于电子层结构相同的离子来说,核电荷数越大,失去电子就越难,则离子的氧化性就越强,所以离子的氧化性aW3+ > bX+,选项C正确;根据离子是原子失去或获得电子形成可知:a-3=c+2,选项D错误。
考点:考查电子层结构相同的离子的性质比较的知识。

练习册系列答案
相关题目
随着卤素原子半径的增大,下列递变规律正确的是
| A.单质的熔点逐渐降低 | B.卤素离子还原性逐渐增强 |
| C.气态氢化物稳定性逐渐增强 | D.单质氧化性逐渐增强 |
根据原子结构及元素周期律的知识,下列推断正确的是
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl?、S2?、Ca2+、K+半径逐渐减小 |
D.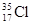 与 与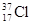 得电子能力相同 得电子能力相同 |
考古学常用14C来确定文物的历史年代,14C原子核内中子数是
| A.6 | B.8 | C.14 | D.20 |
某元素的一种同位素X原子的质量数为A,含N个中子,它与H原子组成HmX分子,在ag HmX分子中含质子的物质的量是 ( )
A. (A-N+m) mol (A-N+m) mol | B.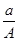 (A-N) mol (A-N) mol | C. ( A-N) mol ( A-N) mol | D.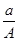 (A-N+m) mol (A-N+m) mol |
甲—辛等八种元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断不正确的是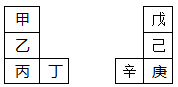
| A.乙的单质在空气中燃烧生成只含离子键的化合物 |
| B.原子半径:辛>己>戊 |
| C.丙与庚的原子核外电子数相差13 |
| D.最高价氧化物的水化物的碱性:丙>乙>甲 |
根据下表中部分短周期元素的原子半径及主要化合价信息:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B. L2+与R2-的核外电子数相等
C.与稀盐酸反应单质Q比单质L快 D.M与T形成的化合物具有两性
下列化合物中阳离子半径与阴离子半径之比最大的是( )
| A.LiI | B.NaBr | C.KCl | D.CsF |
下表为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素。下列说法正确的是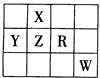
| A.五种元素可能都是金属元素 |
| B.五种元素的原子最外层电子数一定都大于2 |
| C.X的氢化物的沸点一定比Z的氢化物的沸点高 |
| D.R的最高价氧化物对应的水化物一定是强酸 |