题目内容
根据下表中部分短周期元素的原子半径及主要化合价信息:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B. L2+与R2-的核外电子数相等
C.与稀盐酸反应单质Q比单质L快 D.M与T形成的化合物具有两性
D
解析试题分析:A.根据题意可知T、Q是同一主族的元素,由于非金属性T>Q,在H2O之间存在氢键,增加了分子之间的作用力,所以氢化物的沸点所以为H2T>H2R,错误;B.L、R是同一周期的元素,原子失去电子形成阳离子,获得电子形成阴离子,所以 L2+与R2-的核外电子数不相等,错误;C.Q、L是同一主族的元素,由于元素的金属性L>Q,所以与稀盐酸反应单质Q比单质L慢,错误;D.M与T形成的化合物Al2O3是两性氧化物,具有两性,正确。
考点:考查元素周期表、元素周期律的应用的知识。

 阅读快车系列答案
阅读快车系列答案以下元素基态原子电子排布图正确的是 ( )
A.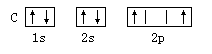 | B.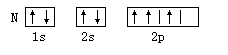 |
C.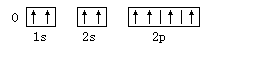 | D. |
神舟十号飞船于2013年6月11日17时38分搭载三位航天员飞向太空,将在轨飞行15天,并首次开展我国航天员太空授课活动。将使中国的探月工程又迈出重要的一步。据预测,月球的土壤中吸附着数百万吨的氦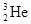 ,可作为未来核聚变的重要原料之一。对
,可作为未来核聚变的重要原料之一。对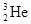 原子的叙述不正确的是 ( )
原子的叙述不正确的是 ( )
| A.质量数是3 | B.质子数是3 | C.中子数是1 | D.电子数是2 |
已知1—18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A.四种元素位于同一周期 | B.氢化物的稳定性H2Y>HZ |
| C.离子的氧化性aW3+ > bX+ | D.a+3=c﹣2 |
下列元素中,属于p区元素的是
| A.H | B.O | C.Fe | D.Mg |
(原创) 参考消息网6月14日报道:美媒称,中国即将批量生产更为优秀的航空发动机。新发动机将适应更高的内部温度,拥有更出色的性能或耐用性,很可能被安装在作战飞机上,这表明中国工程师已掌握了制造镍基含铼单晶合金叶片的技术(因熵增原理,致成品易含杂质,不易制备)。查资料发现:铼(Re)的熔点3180℃,沸点5627℃;纯铼质软,有良好的机械性能;自然界有2种铼原子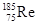 、
、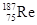 ,下列说法中正确的是
,下列说法中正确的是
| A.镍基含铼单晶合金属于金属晶体 |
B.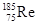 和 和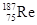 互称为核素 互称为核素 |
| C.铼(Re)元素的相对原子质量为186 |
| D.含铼合金比纯铼的熔点高、硬度大 |
香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等, X、Z位于同主族,Y、Z、R、T位于同周期, R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法不正确的是
| A.原子半径:Y>Z>R>T |
| B.气态氢化物的稳定性:W<R<T |
| C.最高价氧化物对应的水化物碱性:X>Y>Z |
| D.XR2、WR2两化合物中R的化合价相同 |
下表为六种短周期元素的部分性质:
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
A.X与Y可以形成阴离子XY32-
B.元素R的氧化物对应水化物一定为强酸
C.Z的氢化物的沸点比T的氢化物的沸点高
D.由X形成的化合物QX和XR4,其晶体类型不相同