题目内容
【题目】随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式____,计算4.8g甲烷气体完全燃烧生成液态水,放出热量为____kJ。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。
①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4 | H2O | CO | H2 |
3.0 molL1 | 8.5 molL1 | 2.0 molL1 | 2.0 molL1 |
则此时正、逆反应速率的关系是正反应速率____逆反应速率。(填“>”、“<”、“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=___,P=____;设计实验2、3的目的是____;实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1 267.09kJ > 480℃ 303kPa 探究温度对反应速率的影响 K2>K1=K3
【解析】
(1)考查热化学反应方程式的计算,①CH4(g)+2O2(g)= CO2(g)+ 2H2O(g),②H2O(1)=H2O(g),常温常压下,甲烷燃烧后,水以液态形式存在,即热化学反应方程式应为①-2×②,得出CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=(-802.3-2×44.0)kJ·mol-1=-890.3kJ·mol-1;4.8g甲烷气体燃烧生成液态水时放出的热量为4.8g×890.3kJ·mol-1/16g·mol-1=267.09kJ;
(2)①考查化学平衡常数的计算,Qc=![]() =
=![]() ≈0.627<1,说明化学反应向正反应方向进行,即正反应速率>逆反应速率;
≈0.627<1,说明化学反应向正反应方向进行,即正反应速率>逆反应速率;
②本实验探究温度、压强对上述反应速率的影响,根据影响化学反应速率的因素,要求其他条件不变,根据表中数据3、2应探究温度对反应速率的影响,因此t=480℃,1、3应探究压强对反应速率的影响,即p=303kPa,化学平衡常数只受温度的影响,该反应为吸热反应,升高温度,平衡向正反应方向移动,即化学平衡常数增大,即K2>K1=K3。

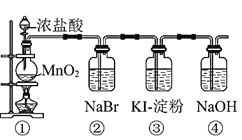
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。
【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
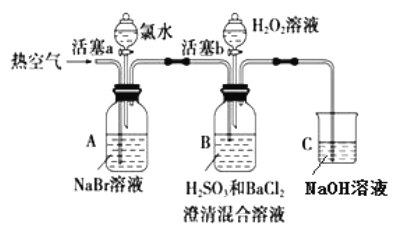
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。
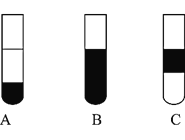
【题目】某兴趣小组制备一定量的乙酸乙酯.取3mL无水乙醇,2mL浓硫酸,2mL冰醋酸进行实验,用5mL饱和碳酸钠溶液收集产物.

I.实验装置如图所示
(1)制备乙酸乙酯的化学方程式为____________。
(2)浓硫酸的作用是_________。
(3)接收装置还可选择下图中的_______。(填序号).

Ⅱ.甲同学用含有酚酞的饱和碳酸钠溶液(呈碱性)收集产物后振荡,发现红色迅速退去.
甲同学认为是蒸出的乙酸中和了碳酸钠.乙同学通过查阅资料并进行如下实验,证明甲同学的推测是错误的。
已知:酚酞难溶于水,易溶于有机溶剂;酚酞试剂是酚酞的乙醇溶液.
实验i,取振荡后的下层无色液体,分成两份,分别完成以下实验
序号 | 实验操作 | 实验现象 | 结论 |
1 | 滴加几滴酸酞试剂 | 溶液______(填“变红”成“不变红”) | 碳酸钠并未被乙酸完全中和,仍有大量剩余 |
2 | 滴入乙酸溶液 | 有大量气泡产 |
实验ii.取振荡后的上层液体,加入____溶液,振荡,发现出现浅红色,静置分层后红色消失。
实验iii,取5mL饱和碳酸钠溶液,滴入几滴酚酞试剂,再加入3mL乙酸乙酯(不含乙酸)振荡,溶液先变红,振荡后红色消失。回答下列问题
(4)完成上述实验:①________。②________。
(5)结合实验ii和实验iii的现象,可得出的结论是__________。
(6)实验iii的实验目的是___________。