题目内容
【题目】已知反应:A(s)+3B(g)![]() 2C(g) ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示。下列说法正确的是( )
2C(g) ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示。下列说法正确的是( )
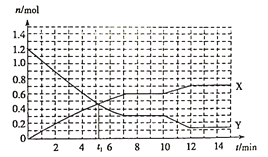
A. X曲线表示B的物质的量随时间变化的关系
B. 第t1 min时说明反应达到了平衡
C. 前4 min,用C表示反应速率为v(C)=0.1 mol·L-1·min-1
D. 第10 min时,可能采取了降温
【答案】D
【解析】
根据图像,在7min时达到平衡,X变化物质的量为0.6mol,Y的物质的量变化了0.9mol,根据化学反应方程式,推出X曲线为C,Y的曲线为B,然后进行分析;
根据图像,在7min时达到平衡,X变化物质的量为0.6mol,Y的物质的量变化了0.9mol,根据化学反应方程式,推出X曲线为C,Y的曲线为B。
A、根据上述分析,X曲线表示C的物质的量随时间变化的关系,故A说法错误;
B、根据图像,7min达到平衡,故B说法错误;
C、根据化学反应速率的定义,v(C)=0.4mol/(10L×4min)=0.01 mol·L-1·min-1,故C说法错误;
D、10min后,X物质的量增大,Y的物质的量降低,说明平衡向正反应方向进行,改变的条件可能是降温,故D说法正确。

【题目】一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:2A(g)![]() B(g)+C(g) ΔH
B(g)+C(g) ΔH
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
A(g) | B(g) | C(g) | ||
Ⅰ | 387 | 0. 20 | 0. 080 | 0. 080 |
Ⅱ | 387 | 0. 40 | ||
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
下列说法不正确的是
A. 该反应的正反应为ΔH<0
B. 207℃,K=4
C. 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同
D. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短
【题目】随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式____,计算4.8g甲烷气体完全燃烧生成液态水,放出热量为____kJ。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。
①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4 | H2O | CO | H2 |
3.0 molL1 | 8.5 molL1 | 2.0 molL1 | 2.0 molL1 |
则此时正、逆反应速率的关系是正反应速率____逆反应速率。(填“>”、“<”、“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=___,P=____;设计实验2、3的目的是____;实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。