题目内容
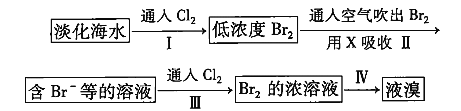
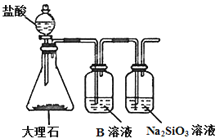
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案进行实验探究:
(1)根据方案一装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:
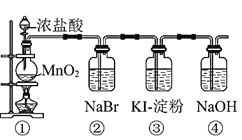
Ⅰ![]() 写出装置①中发生反应的化学方程式:______。
写出装置①中发生反应的化学方程式:______。
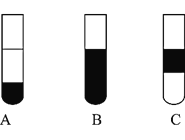
Ⅱ![]() 若将反应后②中的溶液倒入
若将反应后②中的溶液倒入![]() 中,出现的现象与图中吻合的是______。
中,出现的现象与图中吻合的是______。![]() 填代号
填代号![]()
Ⅲ![]() 装置③中的现象是______。
装置③中的现象是______。
(2)根据方案二装置![]() 如图
如图![]() 回答以下问题:
回答以下问题:

Ⅰ![]() 方案二验证元素非金属性递变的理论依据是:______。
方案二验证元素非金属性递变的理论依据是:______。
Ⅱ![]() 装置的作用是______,X是______。
装置的作用是______,X是______。
Ⅲ![]() 能说明碳元素与硅元素非金属性强弱的实验现象是______。
能说明碳元素与硅元素非金属性强弱的实验现象是______。
【答案】![]() 浓
浓![]()
![]() 溶液变蓝色 元素的非金属性越强,最高价氧化物对应水化物的酸性越强。酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强
溶液变蓝色 元素的非金属性越强,最高价氧化物对应水化物的酸性越强。酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强![]() 以强酸制弱酸
以强酸制弱酸![]() 吸收
吸收![]() 中的HCl 饱和
中的HCl 饱和![]() 溶液
溶液 ![]() 中有白色沉淀产生
中有白色沉淀产生
【解析】
(1)Ⅰ.装置①中发生的是浓盐酸和二氧化锰反应生成氯化锰、氯气和水。
Ⅱ.若将反应后②中的溶液倒入CCl4中,单质碘和四氯化碳互溶,四氯化碳密度比水大,因此出现溶液分层,下层为橙红色,上层为无色。
Ⅲ.装置③中的现象是单质碘和淀粉变蓝。
(2)Ⅰ.方案二验证元素非金属性递变的理论依据是:元素的非金属性越强,最高价氧化物对应水化物的酸性越强。酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强酸制弱酸)。
Ⅱ.A中生成二氧化碳,但含有易挥发的HCl,因此B装置的作用是除掉挥发出的HCl杂质,一般用饱和碳酸氢钠。
Ⅲ.二氧化碳通入到硅酸钠溶液中生成碳酸钠和硅酸沉淀。
(1)Ⅰ.装置①中发生的是浓盐酸和二氧化锰反应,其化学方程式:MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O,故答案为:MnO2 + 4HCl(浓)
MnCl2 + Cl2↑+ 2H2O,故答案为:MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O。
MnCl2 + Cl2↑+ 2H2O。
Ⅱ.若将反应后②中的溶液倒入CCl4中,单质碘和四氯化碳互溶,四氯化碳密度比水大,因此出现溶液分层,下层为橙红色,上层为无色,因此出现的现象与图中吻合的是A,故答案为:A。
Ⅲ.装置③中的现象是单质碘和淀粉变蓝,故答案为:溶液变蓝色。
(2)Ⅰ.方案二验证元素非金属性递变的理论依据是:元素的非金属性越强,最高价氧化物对应水化物的酸性越强。酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强酸制弱酸),故答案为:元素的非金属性越强,最高价氧化物对应水化物的酸性越强。酸和盐反应生成新酸和新盐,则反应物的酸比生成物的酸的酸性强(以强酸制弱酸)。
Ⅱ.A中生成二氧化碳,但含有易挥发的HCl,因此B装置的作用是除掉挥发出的HCl杂质,X是饱和碳酸氢钠,主要避免二氧化碳损失,故答案为:吸收CO2中的HCl;饱和NaHCO3溶液。
Ⅲ.二氧化碳通入到硅酸钠溶液中生成碳酸钠和硅酸沉淀,因此能说明碳元素与硅元素非金属性强弱的实验现象是C中有白色沉淀产生,故答案为:C中有白色沉淀产生。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:2A(g)![]() B(g)+C(g) ΔH
B(g)+C(g) ΔH
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
A(g) | B(g) | C(g) | ||
Ⅰ | 387 | 0. 20 | 0. 080 | 0. 080 |
Ⅱ | 387 | 0. 40 | ||
Ⅲ | 207 | 0. 20 | 0. 090 | 0. 090 |
下列说法不正确的是
A. 该反应的正反应为ΔH<0
B. 207℃,K=4
C. 达到平衡时,容器Ⅰ中的A体积分数与容器Ⅱ中的相同
D. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),属于过渡元素的是___(该空格用表中的字母表示)。
(2)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。
(3)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为_________。
【题目】随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式____,计算4.8g甲烷气体完全燃烧生成液态水,放出热量为____kJ。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。
①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4 | H2O | CO | H2 |
3.0 molL1 | 8.5 molL1 | 2.0 molL1 | 2.0 molL1 |
则此时正、逆反应速率的关系是正反应速率____逆反应速率。(填“>”、“<”、“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=___,P=____;设计实验2、3的目的是____;实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。