题目内容
6.0.5NA个NH3的物质的量是0.5mol,质量是8.5g,其中H是1.5mol,质量是1.5g.分析 根据n=$\frac{N}{{N}_{A}}$计算NH3的物质的量,根据m=nM计算NH3的质量;每个NH3分子中含有3个H原子,则n(H)=3n(NH3),根据m=nM计算H原子质量.
解答 解:n(NH3)=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}/mol}$=0.5mol,m(NH3)=nM=0.5mol×17g/mol=8.5g;每个NH3分子中含有3个H原子,则n(H)=3n(NH3)=3×0.5mol=1.5mol,m(H)=nM=1.5mol×1g/mol=1.5g,
故答案为:0.5;8.5;1.5;1.5.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量的关系是解本题关键,易错点是H原子与分子物质的量关系,题目难度不大.

练习册系列答案
相关题目
17.下列说法中,正确的是( )
| A. | 物质的量相同的气体单质具有相同的原子数 | |
| B. | 铁原子的摩尔质量等于它的相对原子质量 | |
| C. | 反应前各反应物的物质的量之和一定等于反应后各生成物的物质的量之和 | |
| D. | 一个氧原子的实际质量等于$\frac{16}{6.02×1{0}^{23}}$g |
14.下列关于NA的说法中,不正确的是( )
| A. | 2NA个H2与NA个O2的质量比为1:8 | |
| B. | 0.5NA个HCl所占的体积约为11.2L | |
| C. | 71gCl2所含的Cl数目为2NA | |
| D. | 1L 0.5mol•L-1FeCl3溶液中含有1.5NA个Cl- |
11.下列关于“摩尔”的理解正确的是( )
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 | |
| C. | 摩尔是表示物质的粒子个数的单位,简称摩,符号为mol | |
| D. | 1mol氧含6.02×1023个O2 |
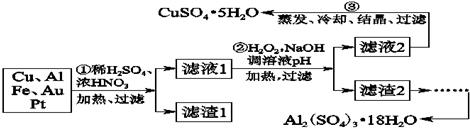
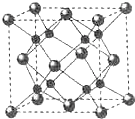 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: