题目内容
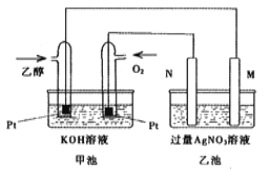
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是( )

A.电池工作的过程中,溶液中SO![]() 浓度基本不变
浓度基本不变
B.电池工作时,溶液中SO![]() 向c移动
向c移动
C.c为负极,发生氧化反应
D.电池工作的过程中,c电极上产生气泡
【答案】D
【解析】
根据装置图可知,电流的方向是从d流向c的,所以d是正极,c是负极。锌比铜活泼,所以锌是负极,铜是正极,即c极为锌、d极为铜,溶液中的氢离子向正极移动,在正极上得到电子,被还原生成氢气。
A.该原电池的总反应为Zn+2H+=Zn2++H2↑,电池工作的过程中,溶液中SO42-浓度基本不变,故A正确;
B.在原电池装置中,阴离子移向负极,即溶液中SO42-向c移动,故B正确;
C.c为负极,Zn失电子发生氧化反应,故C正确;
D.d电极为正极,溶液中的氢离子向正极移动,在正极上得电子生成氢气,产生气泡,故D错误;
答案选D。

【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
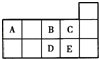
为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
实验 混合溶液 | A | B | C | D | E | F |
4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
请回答下列问题:
①请完成此实验设计,其中:V3=___,V8=___;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___。
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率υ(H2SO4)=___(忽略反应前后溶液体积变化)。