题目内容
【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
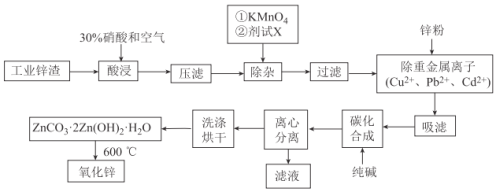
已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________
【答案】加热、将锌渣粉碎、搅拌、适当增大硝酸的浓度等 ZnO、ZnCO3或Zn(OH)2 4.7≤pH<6.0 除去Mn2+ 2MnO4-+3Mn2++ 2H2O =5MnO2↓+4H+ Fe(OH)3、Al(OH)3、MnO2 3Zn(NO3)2+3Na2CO3+3H2O =ZnCO3![]() 2Zn(OH)2
2Zn(OH)2![]() H2O↓+2CO2↑+6NaNO3
H2O↓+2CO2↑+6NaNO3
或3Zn(NO3)2+5Na2CO3+5H2O=ZnCO3![]() 2Zn(OH)2
2Zn(OH)2![]() H2O↓+4NaHCO3+6NaNO3 静置,取上层清液少许于试管中,往试管中继续滴加碳酸钠溶液,若无沉淀产生,则纯碱过量
H2O↓+4NaHCO3+6NaNO3 静置,取上层清液少许于试管中,往试管中继续滴加碳酸钠溶液,若无沉淀产生,则纯碱过量
【解析】
(1)加快锌渣浸出可根据增大反应物接触面积、升高温度、增大反应物浓度的角度分析;
(2)根据除杂的同时不要掺入新的杂质考虑,根据流程及表中的数据,确定pH的范围;
(3)除杂时加入高锰酸钾的作用是将Mn2+转化为MnO2沉淀,除去Mn2+;
(4)由(2)、(3)可知“过滤”所得的滤渣;
(5)“碳化合成”时加入碳酸钠,产物为ZnCO3![]() 2Zn(OH)2
2Zn(OH)2![]() H2O,以此写出化学方程式;若碳酸钠不足,检验溶液中的Zn2+,若碳酸钠过量,用盐酸检验溶液中的CO32-;
H2O,以此写出化学方程式;若碳酸钠不足,检验溶液中的Zn2+,若碳酸钠过量,用盐酸检验溶液中的CO32-;
(1)酸浸的主要目的是将ZnO等物质与硝酸反应,为加快反应速率,可采取的措施有加热、将锌渣粉碎、搅拌、适当增大硝酸的浓度等;
(2)加入试剂X的目的为调节溶液的pH,使Fe3+、Al3+生成沉淀除去,为不引入新的杂质,可加入ZnO或ZnCO3或Zn(OH)2等,根据流程及表中的数据,需调节pH的范围为4.7≤pH<6.0;
(3)加入高锰酸钾的作用是将Mn2+转化为MnO2沉淀,除去Mn2+,反应的离子方程式为2MnO4-+ 3Mn2++ 2H2O =5 MnO2↓+4H+;
(4)由(2)、(3)可知“过滤”所得的滤渣的主要成分是Fe(OH)3、Al(OH)3、MnO2;
(5)“碳化合成”时加入碳酸钠,产物为ZnCO3![]() 2Zn(OH)2
2Zn(OH)2![]() H2O,反应的化学方程式为:
H2O,反应的化学方程式为:
3Zn(NO3)2+3Na2CO3+3H2O =ZnCO3![]() 2Zn(OH)2
2Zn(OH)2![]() H2O↓+2CO2↑+6NaNO3
H2O↓+2CO2↑+6NaNO3
或3Zn(NO3)2+5Na2CO3+5H2O=ZnCO3![]() 2Zn(OH)2
2Zn(OH)2![]() H2O↓+4NaHCO3+6NaNO3;若碳酸钠过量,则沉淀后的溶液中有碳酸根离子,检查碳酸根离子的方法是:静置,取上层清液少许于试管中,往试管中继续滴加碳酸钠溶液,若无沉淀产生,则纯碱过量。
H2O↓+4NaHCO3+6NaNO3;若碳酸钠过量,则沉淀后的溶液中有碳酸根离子,检查碳酸根离子的方法是:静置,取上层清液少许于试管中,往试管中继续滴加碳酸钠溶液,若无沉淀产生,则纯碱过量。

 名校课堂系列答案
名校课堂系列答案