题目内容
【题目】根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。
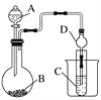
(1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。
(3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。
【答案】分液漏斗 防倒吸 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O Cl2+S2-=S↓+2Cl- ①、④ CO2+H2O+SiO32-=H2SiO3↓+CO32- HNO3有挥发性,也会和硅酸钠反应生成硅酸
【解析】
(1)根据仪器结构特点分析;氯气溶于水,需要防倒吸;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证;
(3)要证明非金属性:N>C>Si,则利用此装置证明最高价氧化物水化物的酸性的强弱顺序为:HNO3>H2CO3>H2SiO3,硝酸有挥发性,干扰碳酸与硅酸的强弱比较。
(1)仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,故答案为:分液漏斗;防止倒吸;
(2)设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,烧瓶中发生反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为S2-+Cl2═S↓+2Cl-,故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;S2-+Cl2═S↓+2Cl-;
(3)根据强酸制强酸的原理,利用稀硝酸溶解碳酸钙,将生成的CO2通入硅酸钠溶液中即可推断酸性的弱顺序为:HNO3>H2CO3>H2SiO3,即A为稀硝酸、B为碳酸钙、C为硅酸钠溶液;试管中发生反应的离子方程式为CO2+H2O+SiO32-=H2SiO3↓+CO32-;因硝酸有挥发性,生成的CO2气体中混有硝酸蒸气,需要除去,否则会干扰碳酸与硅酸的强弱比较,故答案为:①④;CO2+H2O+SiO32-=H2SiO3↓+CO32-;HNO3有挥发性,也会和硅酸钠反应生成硅酸;