��Ŀ����
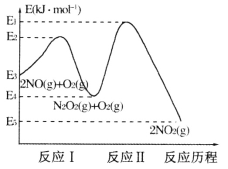
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ (i)I2(g)+H2(g)![]() 2HI(g) ��H=" -" 9.48kJ/mol ��(ii) I2(s)+H2(g)
2HI(g) ��H=" -" 9.48kJ/mol ��(ii) I2(s)+H2(g)![]() 2HI(g) ��H=" +" 26.48kJ/mol�������ж���ȷ����
2HI(g) ��H=" +" 26.48kJ/mol�������ж���ȷ����
A. 254g I2(g)��ͨ��2g H2(g)����Ӧ����9.48 kJ
B. 1 mol��̬����1mol��̬���������������l7.00 kJ
C. ��Ӧ(i)�IJ���ȷ�Ӧ(ii)�IJ����ȶ�
D. ��Ӧ(i) ��1mol I-I����1mol H-H����Ҫ��������С�ڲ�2mol H-I����Ҫ��������
���𰸡�D
�������������������Ӧ�ǿ��淴Ӧ��ת���ʴﲻ��100������A�����ݸ�˹���ɿ�֪�����������õ�I2(s)��I2(g)����H����35.96kJ/mol����B��������Ӧ�IJ���Ϊ��ͬ״̬��ͬ�����ʣ��ȶ�����ͬ����C������H=��Ӧ������ܺ�-��������ܺͣ���Ӧ(i)Ϊ���ȷ�Ӧ���ʷ�Ӧ������ܺʹ��ڲ�������ܺͣ���D��ȷ��

����Ŀ������п��ҵƷ�㷺Ӧ������Ϳ�ϡ��մɡ�������ҽҩ�������͵��ӵ���ҵ�����Ź�ҵ�ķ��ٷ�չ���ҹ�������п���������������ӣ���Ϊ���ý����в���ȱ�ٵ���Ҫ��������ԭ�Ϻ����Ͳ��ϡ��ù�ҵ��п����(��Ҫ�ɷ�ΪZnO����������������ͭ�������Mn2+��Pb2+��Cd2+��)��ȡ����п�Ĺ���������ͼ��ʾ��
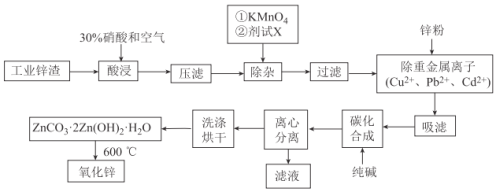
��֪����ؽ�������c(Mn+)=0.1mol/L�����������������pH���±���ʾ��
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
��ʼ���� | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
������ȫ | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
�ش���������:
(1)Ϊ��֤п������ij�֣��ȱ������������c(H+)=0.5mol/L���ҡ�д��һ�ּӿ�п�������ķ�����_______________
(2)Ϊ������Һ��pH�����Լ�XΪ__________________(�ѧʽ)���ҵ�����ҺpH�ķ�Χ��____________
(3)����ʱ���������ص�������_______________��������Ӧ�����ӷ���ʽΪ_____________
(4)��������������������Ҫ�ɷ���_____________________(�ѧʽ)
(5)д����̼���ϳ����Ļ�ѧ����ʽ��_____________________;��̼���ϳ��������贿���Թ����������ʵ�鷽��֤�����������_____________________