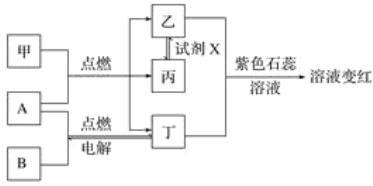
题目内容
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也有着广泛的应用。
(1)基态B原子的价电子排布图为_____________________,其第一电离能比Be__________(填“大”或“小”)。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。配离子[BH4]-的中心原子的杂化方式为________,写出与其互为等电子体的一种阳离子和一种分子的化学式:_________________。
(3)三氯化硼的沸点为12.5℃,而氯化镁的沸点高于1200℃,原因是____________________________________。
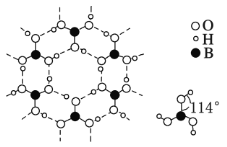
(4)硼酸晶体是片状结构,下图表示的是其中一层的结构。每一层内存在的作用力有______________;硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是 _____________________________________________。
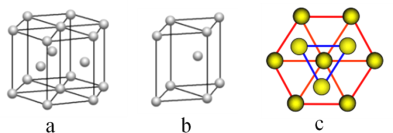
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伽德罗常数为NA,则镁的摩尔质量计算式为________________。
【答案】![]() 小 sp3杂化 NH4+、CH4 三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱 共价键、氢键 在冷水中,晶体中硼酸分子间以氢键缔合在一起,难以溶解;在热水中,晶体中部分氢键被破坏,溶解度增大 六方最密堆积 12NA·a·ρ
小 sp3杂化 NH4+、CH4 三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱 共价键、氢键 在冷水中,晶体中硼酸分子间以氢键缔合在一起,难以溶解;在热水中,晶体中部分氢键被破坏,溶解度增大 六方最密堆积 12NA·a·ρ
【解析】
(1)基态B原子核外有5个电子,根据构造原理,基态B原子的价电子排布图为![]() ;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族元素的价层电子排布为ns2,为全充满状态,因此其第一电离能大于其相邻元素;Be、B位于同一周期且Be、B分别位于第IIA族、第IIIA族,B第一电离能比Be小;
;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族元素的价层电子排布为ns2,为全充满状态,因此其第一电离能大于其相邻元素;Be、B位于同一周期且Be、B分别位于第IIA族、第IIIA族,B第一电离能比Be小;
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。配离子[BH4]-的中心原子B原子价层电子对个数![]() ,根据价层电子对互斥理论判断B的杂化方式为sp3杂化;[BH4]-的等电子体中含有5个原子,价电子数是8,与其互为等电子体的一种阳离子和一种分子的化学式:NH4+、CH4;
,根据价层电子对互斥理论判断B的杂化方式为sp3杂化;[BH4]-的等电子体中含有5个原子,价电子数是8,与其互为等电子体的一种阳离子和一种分子的化学式:NH4+、CH4;
(3)三氯化硼是共价型分子,三氯化硼的沸点为12.5℃,而氯化镁的沸点高于1200℃,沸点不同的原因是:三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱;
(4)硼酸晶体是片状结构,根据图中一层的结构,每一层内存在的作用力有共价键、氢键;硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是在冷水中,晶体中硼酸分子间以氢键缔合在一起,难以溶解;在热水中,晶体中部分氢键被破坏,溶解度增大;
(5)根据镁单质晶体中原子的堆积模型图,镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,它的堆积模型名称为六方最密堆积;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg·cm-3,晶胞是图中的b,紧邻的四个镁原子的中心连线构成的几何体为正四面体,该正四面体的高为晶胞的高的![]() ,可推知四面体的体积为整个晶胞的
,可推知四面体的体积为整个晶胞的![]() ,而晶胞中含有的镁原子数为1+8×
,而晶胞中含有的镁原子数为1+8×![]() =2,则晶胞质量=
=2,则晶胞质量=![]() g,则ρg·cm-3=
g,则ρg·cm-3=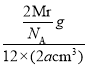 ,则有Mr=12NA·a·ρ,阿伏伽德罗常数为NA,则镁的摩尔质量计算式为12NA·a·ρ。
,则有Mr=12NA·a·ρ,阿伏伽德罗常数为NA,则镁的摩尔质量计算式为12NA·a·ρ。

 口算题天天练系列答案
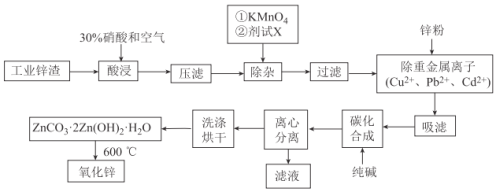
口算题天天练系列答案【题目】氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
已知:相关金属离子c(Mn+)=0.1mol/L生成氢氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________(填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________(填化学式)
(5)写出“碳化合成”的化学方程式:_____________________;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________