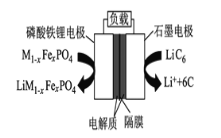
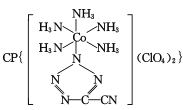
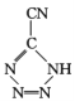
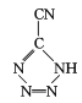
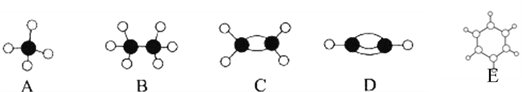
题目内容
【题目】最近报道的一种处理垃圾酸性渗滤液并用其发电的示意图如下(注:盐桥可使原电池两极形成导电回路)。装置工作时,下列说法错误的是
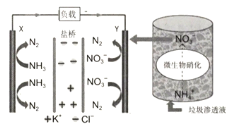
A.Y极为负极
B.化学能转变为电能
C.电子由X极沿导线流向Y极
D.Y极发生的反应为2NO![]() +10e-+12H+=N2+6H2O,周围pH增大
+10e-+12H+=N2+6H2O,周围pH增大
【答案】A
【解析】
A.NH3N2化合价升高失电子,发生氧化反应,X做负极;NO![]() N2化合价降低得电子,发生还原反应,Y做正极, 故A错误;
N2化合价降低得电子,发生还原反应,Y做正极, 故A错误;
B.垃圾在微生物的作用下,发生氧化还原反应,形成了原电池,所以化学能转变为电能,故B正确;
C.根据A分析知X为负极,Y为正极, 电子由负极X 极沿导线流向正极Y ,故C正确;
D.Y 极为正极发生的反应为2NO![]() +10e- +12H+=N2+6H2O,消耗H+,所以pH 增大,故D正确;
+10e- +12H+=N2+6H2O,消耗H+,所以pH 增大,故D正确;
故答案:A。

【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是___(填元素名称),写出⑧的原子结构示意图____________。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是____。
(3)①与⑤形成的化合物中,化学键类型为____。
(4)⑦与⑨形成的化合物的电子式为__,②与④形成的原子个数比为1:2的化合物的结构式为__。
(5)①与②形成的一种烃,具有平面正六边形结构,相对分子质量为78,写出此烃发生取代反应的化学方程式(任写一个即可):_。
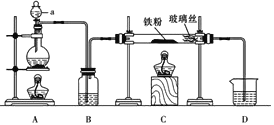
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
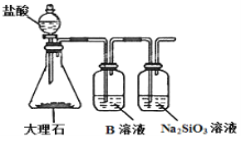
①溶液B为______,B溶液的作用是______。
②若看到_______现象,即可证明酸性_______(用化学式回答),则非金属性______(用元素符号回答)。