题目内容
4.下列物质长期放置在空气中能发生氧化还原反应的是( )| A. | Na2O2 | B. | Na2SO4 | C. | Na2CO3 | D. | NaOH |
分析 发生氧化还原反应而变质的化合物,应具有氧化性或还原性,且可与空气中的水或二氧化碳发生氧化还原反应,以此解答.
解答 解:A.Na2O2可与空气中的水或二氧化碳反应生成氧气,为氧化还原反应,故A正确;
B.Na2SO4性质稳定,放在空气中不变质,故B错误;
C.Na2CO3在空气中不变质,故C错误;
D.NaOH与空气中二氧化碳反应,易变质,不是氧化还原反应,故D错误;
故选A.
点评 本题综合考查钠的化合物知识,侧重于元素化合物知识的综合运用的考查,注意把握元素知识,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
14.下列事实能说明某元素的非金属性比Si强的是( )
| 事实 | 非金属性强弱 | |
| A | CH4受热分解的温度比SiH4高 | C>Si |
| B | C与SiO2在高温下反应生成Si和CO | C>Si |
| C | 稀盐酸与Na2SiO3溶液反应生成H2SiO3胶体 | Cl>Si |
| D | H2SO3是中强酸,H2SiO3是弱酸 | S>Si |
| A. | A | B. | B | C. | C | D. | D |
12.“混盐”是指一种金属离子与多种酸根离子构成的盐,如CaOCl2就是一种混盐.“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐,如KAl(SO4)2就是一种复盐.下列各化合物中属于混盐的是( )
| A. | Ca(NO3)Cl | B. | (NH4)2Fe(SO4)2 | C. | NaHCO3 | D. | K3[Fe(CN)6] |
19.下列关于胶体的说法错误的是( )
| A. | 胶体外观不均匀 | B. | 胶体粒子直径通常小于1 nm | ||
| C. | 胶体一定是混合物 | D. | 胶体一定是液体 |
9.下列各组物质中,因反应条件、用量、浓度等不同而发生不同化学反应的是( )
①Cu与硝酸;②盐酸与NaHCO3;③AlCl3与NaOH;④O2 与Na;⑤CO2 与Ca(OH)2.
①Cu与硝酸;②盐酸与NaHCO3;③AlCl3与NaOH;④O2 与Na;⑤CO2 与Ca(OH)2.
| A. | 除②外 | B. | 除①外 | C. | 除⑤外 | D. | 全部 |
16.NaHCO3在日常生活和工农业生产中有重要用途,关于NaHCO3的说法不正确的是( )
| A. | 是一种钠盐 | B. | 是一种酸式盐 | C. | 水溶液显酸性 | D. | 是一种电解质 |
13.下列有关实验操作和现象描述的对应关系正确的是( )
| A. | 向AlCl3溶液中逐滴加入氨水,产生白色沉淀后消失 | |
| B. | 向Na2SiO3溶液中逐滴加入稀盐酸,产生白色胶状物 | |
| C. | 将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀 | |
| D. | 将砂纸打磨过的铝箔加热至熔化,熔化的铝以小液滴的形式滴落下来 |
3.短周期元素X、Y的原子序数相差2,下列有关叙述正确的是( )
| A. | X、Y不可能位于同一主族 | B. | X、Y一定位于同一周期 | ||
| C. | X、Y可能形成离子化合物XY | D. | X、Y不可能形成共价化合物XY2 |
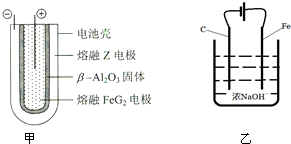 铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.