题目内容
18.已知热化学方程式:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g)△H=-1256kJ•mol-1.下列说法正确的是( )| A. | C2H2的燃烧热为1256kJ/mol | |
| B. | 若生成2mol液态水,则△H=-2512kJ/mol | |
| C. | 若转移10mol电子,则消耗2.5mol O2 | |
| D. | 若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、气态水变为液态水放热;
C、依据氧化还原反应电子守恒计算分析计算;
D、形成4mol碳氧共用电子对是形成1mol二氧化碳.
解答 解:A、热化学方程式中水是气体不是稳定的氧化物,所以燃烧热应大于1256kJ/mol,故A错误;
B、气态水变为液态水放热,若生成2mol液态水,则△H<-2512kJ/mol,故B错误;
C、依据反应化学方程式可知消耗2.5mol氧气,电子转移为10mol,故C正确;
D、若形成4mol碳氧共用电子对,化学方程式中生成1mol二氧化碳,则放出的热量为628kJ,故D错误;
故选C.
点评 本题考查了燃烧热的概念分析判断,氧化还原反应的电子转移计算应用,盖斯定律的应用,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
9.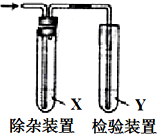 用如图所示装置检验气体时试剂X没必要或是错误的是( )
用如图所示装置检验气体时试剂X没必要或是错误的是( )
 用如图所示装置检验气体时试剂X没必要或是错误的是( )
用如图所示装置检验气体时试剂X没必要或是错误的是( )| 检验的气体 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热制备的乙烯 | H2O | Br2的CCl4溶液 |
| B | CH3CH2OH与浓H2SO4共热170℃制备的乙烯 | NaOH溶液 | 酸性KMnO4溶液 |
| C | 电石与饱和食盐水反应制备的乙烯 | 水 | 酸性KMnO4溶液 |
| D | 苯,液溴,铁屑混合反应生成的HBr | CCl4 | 硝酸银溶液 |
| A. | A | B. | B | C. | C | D. | D |
6.下列物质在常温常压下呈气态的是( )
| A. | 甲醛 | B. | 甲酸 | C. | 甲醇 | D. | 甲苯 |
13.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙醇(水):加新制生石灰,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
3.下列说法正确的是( )
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 镀锌铁皮的镀层损坏后,铁还是受到保护而难以腐蚀 | |
| C. | 钢铁的腐蚀通常有吸氧腐蚀和析氢腐蚀,通常情况下以吸氧腐蚀为主 | |
| D. | 氯碱工业中,阳极发生的反应为:2H++2e-═H2↑ |
10.下列烷烃的命名正确的是( )
| A. | 2,4-二乙基戊烷 | B. | 2,3,3-三甲基戊烷 | ||
| C. | 2-甲基-3-丙基戊烷 | D. | 4-甲基-2-乙基已烷 |
7.下列原子序数所对应的元素组中,两者可形成离子键的是( )
| A. | 1和17 | B. | 15和8 | C. | 14和 6 | D. | 12和9 |
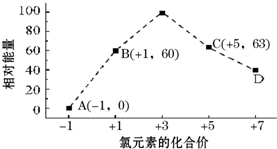 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
