题目内容
8. 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是B、C(填序号).
A.Cl2、Br2、I2的熔点
B.Cl2、Br2、I2的氧化性
C.HCl、HBr、HI的热稳定性
D. HCl、HBr、HI的酸性
(2)工业上,通过如下转化可制得KClO3晶体:

①完成Ⅰ中反应的总化学方程式:NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑.
②Ⅱ中转化的基本反应类型是复分解反应,该反应过程能析出KClO3晶体而无其它晶体析出的原因是室温下KClO3在水中的溶解度明显小于其它晶体.
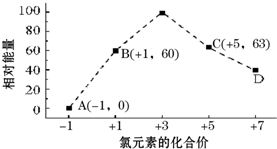
(3)一定条件,在水溶液中1mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图所示.
①D是ClO4-(填离子符号).
②B→A+C的反应中,生成1mol C,同时会消耗3molB,
并放出117KJ的热量(填吸收或放出以及具体数值).
分析 (1)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强;
(2)工业上,通过如下转化可制得KClO3晶体: ,电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
,电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气;两种化合物相互交换成分生成另外的两种化合物的反应为复分解反应,相同温度下,溶解度小的物质先析出;
(3)①根据图可知,D中Cl元素化合价为+7价,据此判断x值;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol.
解答 解:(1)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,
故选B、C;
(2)工业上,通过如下转化可制得KClO3晶体: ,
,
①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应Ⅰ反应方程式为NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑,
故答案为:NaCl+3H2O$\frac{\underline{\;通电\;}}{△}$NaClO3+3H2↑;
②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3,
故答案为:复分解反应;室温下KClO3在水中的溶解度明显小于其它晶体;
(3)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,
故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,生成1mol ClO3-,同时会消耗 3molClO-,该反应的反应热=(63kJ/mol+2×0kJ/mol)-3×60kJ/mol=-117kJ/mol,所以生成1mol ClO3-会放出117kJ的热量,
故答案为:3;放出117.
点评 本题以卤族元素为载体考查了氧化还原反应、热化学反应、非金属强弱的判断方法等知识点,根据物质的性质、原子结构结合元素周期律等知识点来分析解答,题目难度中等.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
| A. | 分子中含有2种官能团 | |
| B. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可与乙醇、乙酸反应,且反应类型相同 |
| A. | 将铁屑、溴水、苯混合制溴苯 | |
| B. | 在苯中滴入浓硝酸制硝基苯 | |
| C. | 用乙醇和乙酸混合共热制取乙酸乙酯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
| A. | CH4 | B. | C2H4 | C. | NaCl | D. | HCl |
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 二氧化硫 |
| A. | H+、K+、Mg2+、Cl- | B. | Ba2+、SO42-、Cl-、OH- | ||
| C. | K+、OH-、CO32-、MnO4- | D. | Ca2+、H+、Cl-、HCO3- |
| A. | C2H2的燃烧热为1256kJ/mol | |
| B. | 若生成2mol液态水,则△H=-2512kJ/mol | |
| C. | 若转移10mol电子,则消耗2.5mol O2 | |
| D. | 若形成4mol碳氧共用电子对,则放出的热量为2512kJ |