题目内容
8.从某物质A的水溶液出发有如图所示的一系列变化: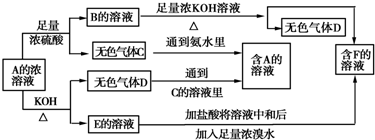
试回答:
(1)物质的化学式:
A(NH4)2SO3或NH4HSO3,
CSO2,
EK2SO3.
(2)写出E→F的离子方程式:SO32-+Br2+H2O═SO42-+2Br-+2H+.
(3)请设计鉴定物质F的实验方案:焰色反应鉴定K+,加BaCl2和盐酸鉴定SO42-.
分析 B+KOH$\frac{\underline{\;\;△\;\;}}{\;}$气体D,从碱性溶液中逸出的气体比较少,且是加热下才逸出,可初步判定D为NH3,则B及A的溶液中均含有NH4+,判断其阴离子要根据A与足量浓硫酸的反应产生无色气体C和A的浓溶液与KOH共热产生NH3和E的溶液,据图示C气体为酸性气体,且E的溶液含有相应的酸根阴离子,又因为此阴离子与浓H2SO4反应生成气体C,同时该阴离子又可以与浓溴水反应,所以此阴离子中必有SO32-或HSO3-,所以A为(NH4)2SO3或NH4HSO3,由A的溶液+KOH→E+D,知E为K2SO3,C为SO2,由A的溶液+浓H2SO4→B+C,知B是NH4HSO4或(NH4)2SO4,推知F为K2SO4,据此答题.
解答 解:B+KOH$\frac{\underline{\;\;△\;\;}}{\;}$气体D,从碱性溶液中逸出的气体比较少,且是加热下才逸出,可初步判定D为NH3,则B及A的溶液中均含有NH4+,判断其阴离子要根据A与足量浓硫酸的反应产生无色气体C和A的浓溶液与KOH共热产生NH3和E的溶液,据图示C气体为酸性气体,且E的溶液含有相应的酸根阴离子,又因为此阴离子与浓H2SO4反应生成气体C,同时该阴离子又可以与浓溴水反应,所以此阴离子中必有SO32-或HSO3-,所以A为(NH4)2SO3或NH4HSO3,由A的溶液+KOH→E+D,知E为K2SO3,C为SO2,由A的溶液+浓H2SO4→B+C,知B是NH4HSO4或(NH4)2SO4,推知F为K2SO4,
(1)根据上面的分析可知,A为(NH4)2SO3或NH4HSO3,C为SO2,E为K2SO3,
故答案为:(NH4)2SO3或NH4HSO3;SO2;K2SO3;
(2)E→F的离子方程式为 SO32-+Br2+H2O═SO42-+2Br-+2H+,
故答案为:SO32-+Br2+H2O═SO42-+2Br-+2H+;
(3)F为K2SO4,可分别检验K+和SO42-,可用焰色反应鉴定K+,透过蓝色钴玻璃,观察火焰呈紫色;用BaCl2检验SO42-,取少量F的溶液加入BaCl2和盐酸的溶液,若产生白色沉淀,证明SO42-的存在,
故答案为:焰色反应鉴定K+,加BaCl2和盐酸鉴定SO42-.
点评 本题主要考查常见无机物推断与性质,涉及离子方程式、离子检验等知识,中等难度,物质推断是解题的关键,注意常见物质的间的反应特征和现象.

| A. | C2H2的燃烧热为1256kJ/mol | |
| B. | 若生成2mol液态水,则△H=-2512kJ/mol | |
| C. | 若转移10mol电子,则消耗2.5mol O2 | |
| D. | 若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
| A. | 含有AlO2-的溶液中:Na+、Al3+、NO3-、Cl- | |
| B. | 使淀粉碘化钾变蓝的溶液中:K+、HCO3-、S2-、SO42- | |
| C. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Na+ | |
| D. | 透明溶液中:Na+、MnO4-、Na+、SO42- |
| A. | 标准状况下,反应过程中得到7.84 L的气体 | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(Na+)=1.5 mol•L-1 |
| A. | 硫氢化钠的水解:HS-+H2O═S2-+H3O+ | |
| B. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O═4OH- | |
| D. | 碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-═CO32-+H2O |
| A. | 氧 | B. | 氯 | C. | 钠 | D. | 氢 |
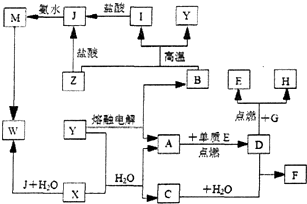
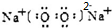 ; D的结构式O=C=O.
; D的结构式O=C=O.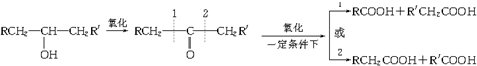
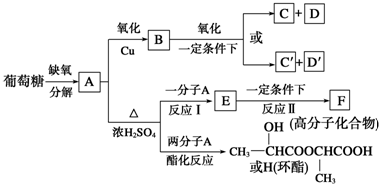
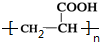 ,H
,H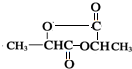 .
.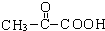 +2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
+2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O. 向100mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),测得最后溶液的pH>7.
向100mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),测得最后溶液的pH>7.