题目内容
9.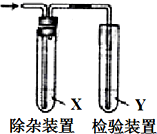 用如图所示装置检验气体时试剂X没必要或是错误的是( )
用如图所示装置检验气体时试剂X没必要或是错误的是( )| 检验的气体 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热制备的乙烯 | H2O | Br2的CCl4溶液 |
| B | CH3CH2OH与浓H2SO4共热170℃制备的乙烯 | NaOH溶液 | 酸性KMnO4溶液 |
| C | 电石与饱和食盐水反应制备的乙烯 | 水 | 酸性KMnO4溶液 |
| D | 苯,液溴,铁屑混合反应生成的HBr | CCl4 | 硝酸银溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.CH3CH2Br与NaOH乙醇溶液共热制备的乙烯中含有乙醇,乙醇不与Br2的CCl4溶液反应;
B.乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,二氧化硫、乙醇能与KMnO4酸性溶液反应,SO2中+4价S具有还原性,能还原酸性KMnO4溶液,使其紫色褪去,乙醇也能被KMnO4酸性溶液氧化;
C.X可除去混有的硫化氢,Y可检验乙炔;
D.溴单质易挥发.
解答 解:A.乙醇易挥发,CH3CH2Br与NaOH乙醇溶液共热: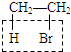 +NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,含有的杂质乙醇,乙醇不与Br2的CCl4溶液反应,无需分离乙醇和乙烯,故A错误;
+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,含有的杂质乙醇,乙醇不与Br2的CCl4溶液反应,无需分离乙醇和乙烯,故A错误;
B.乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,CH3-CH2-OH $→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,同时乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,反应为C2H5OH+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2C+2SO2↑+5H2O,含有杂质乙醇、二氧化硫、二氧化碳,二氧化硫、乙醇能与KMnO4酸性溶液反应,2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,导致酸性KMnO4溶液褪色,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4,使KMnO4酸性溶液褪色,故需用NaOH溶液分离,NaOH溶液能溶解乙醇,能和二氧化硫反应,故B正确;
C.X可除去混有的硫化氢,X应为硫酸铜溶液,Y可检验乙炔,由图可知,Y中观察到褪色可检验乙烯,故C错误;
D.溴单质易挥发,溴单质的水溶液能与硝酸银反应生成沉淀,故需要先用四氯化碳除去,故D正确.
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的制备、有机物的性质及混合物分离提纯、检验等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及实验评价性分析,题目难度不大.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 二氧化硫 |
| A. | H+、K+、Mg2+、Cl- | B. | Ba2+、SO42-、Cl-、OH- | ||
| C. | K+、OH-、CO32-、MnO4- | D. | Ca2+、H+、Cl-、HCO3- |
| A. | C、S、N所形成的氧化物均为酸性氧化物 | |
| B. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
| A. | C2H2的燃烧热为1256kJ/mol | |
| B. | 若生成2mol液态水,则△H=-2512kJ/mol | |
| C. | 若转移10mol电子,则消耗2.5mol O2 | |
| D. | 若形成4mol碳氧共用电子对,则放出的热量为2512kJ |
| A. | 含有AlO2-的溶液中:Na+、Al3+、NO3-、Cl- | |
| B. | 使淀粉碘化钾变蓝的溶液中:K+、HCO3-、S2-、SO42- | |
| C. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Na+ | |
| D. | 透明溶液中:Na+、MnO4-、Na+、SO42- |
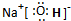 物质I是极性分子(填极性或非极性)
物质I是极性分子(填极性或非极性)
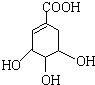
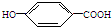 ),其反应类型是消去反应.
),其反应类型是消去反应.
 +H2O.
+H2O.