题目内容
19.某有机物A的结构简式如图所示,下列有关叙述正确的是( )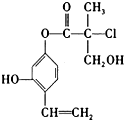
| A. | 1mol A最多可以与2mol Br2发生反应 | |
| B. | A在一定条件下可以发生消去反应和取代反应 | |
| C. | 一个A分子中最多有8个碳原子在同一平面上 | |
| D. | 1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |
分析 由结构简式可知该分子中含有酯基、醇羟基、酚羟基和碳碳双键,所以应该具有酯、醇、酚、烯烃的性质,以此解答该题.
解答 解:A.能与溴发生反应的官能团为酚羟基邻、对为氢原子的取代反应以及碳碳双键的加成,1molA最多可与3molBr2发生反应,故A错误;
B.含有-Cl,可发生消去和取代反应,另外酚羟基、酯基、羟基都可发生取代反应,故B正确;
C.苯环、碳碳双键都为平面形结构,且与苯环直接相连的原子在同一个平面上,分子中最多有10个C原子(苯环、碳碳双键、酯基)在同一个平面,故C错误;
D.能与氢氧化钠反应的官能团为酚羟基、酯基和氯原子,且酯基可水解生成酚羟基,则1molA与足量的NaOH反应,最多可以消耗4molNaOH,故D错误.
故选B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查分析能力,明确官能团与性质的关系即可解答,熟练掌握常见有机物的官能团及其性质,难度不大.

练习册系列答案
相关题目
10.NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 1mol乙烯与乙醇的混合物在氧气中充分燃烧,消耗氧气的分子数为一定为3NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 0.1mol乙烷分子中含有的共价键数目为0.7NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
7.在周期表中,同一主族元素化学性质相似.但是也发现有些元素的化学性质和它在周期表左上方或右下角的另一主族元素性质相似,这称为对角线规则.下列有关锂及其化合物的叙述中正确的是( )
①锂单质跟钠单质的保存方法一样,均可保存在煤油中
②金属锂在空气中燃烧时,生成Li2O
③氢氧化锂的碱性比氢氧化铷弱.
①锂单质跟钠单质的保存方法一样,均可保存在煤油中
②金属锂在空气中燃烧时,生成Li2O
③氢氧化锂的碱性比氢氧化铷弱.
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ②③ |
14.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 发生硝化反应时,苯需要加热,甲苯在常温下就能进行 | |
| C. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| D. | 乙烯能发生加成反应,乙烷不能发生加成反应 |
4.L一多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下: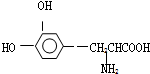 这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )
 这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )| A. | 该有机物可看作氨基酸,也可看作是酚类物质 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 分子中至少有7个碳原子在同一平面内 | |
| D. | 既能与溴水发生取代反应,又能与溴水发生加成反应 |
1.某聚合物具有如下结构片段: ,其单体不可能具有的化学性质是( )
,其单体不可能具有的化学性质是( )
 ,其单体不可能具有的化学性质是( )
,其单体不可能具有的化学性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 与NaOH溶液共热可生成一种钠盐 | ||
| C. | 能催化加氢生成2甲基丙酸甲酯 | D. | 能发生缩聚反应 |
2.检验SO2中是否混有CO2气体,可采用的方法是( )
| A. | 通过品红溶液,若品红溶液褪色,则说明混有CO2气体 | |
| B. | 通过澄清石灰水,若变混浊,则说明混有CO2气体 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水,若变混浊,则说明混有CO2气体 | |
| D. | 先通过足量KMnO4溶液(具有强氧化性),再通过澄清石灰水,若变混浊,则说明混有CO2气体 |
