题目内容
20.(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有①有无色无味气体生成,②溶液颜色变深或溶液为红褐色或久置有红褐色沉淀.用离子方程式表示产生上述现象的原因Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O.(2)在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,这种单质是C.
A.磷 B.硫 C.镁 D.铜
(3)设0.1mol•L-1NaHCO3,NH4HCO3,NaHSO4,NaCl和氨水中的水的电离度分别为a1,a2,a3,a4,a5,水的电离度由大到小的顺序a2>a1>a4>a5 >a3
(4)常温下,在0.10mol•L-1NaX溶液中水的电离度为a1,在0.01mol•L-1HCl溶液中,水的电离度为a2,若$\frac{{a}_{1}}{{a}_{2}}$=108,则0.10mol•L-1NaX溶液的pH是10
(5)25℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中,c(NH4+)与c(SO42-)之比是=2:1(填“大于”、“小于”或“=”)
分析 (1)氯化铁水解呈酸性,可使碳酸钙溶解生成二氧化碳气体,溶液中水解平衡正向进行生成,以此解答;
(2)饱和氯化铁溶液中存在Fe3++3H2O?Fe(OH)3+3H+,若生成气体和红褐色沉淀,平衡正向进行,且加入的物质和酸反应放出氢气;
(3)酸或碱均抑制水的电离,电离呈酸性的酸式盐抑制水的电离,弱酸或弱碱的弱根离子,促进水的电离;
(4)根据电离度之比等于溶液中水电离的氢氧根离子浓度之比,求出水电离的氢氧根离子浓度,再求出pH;
(5)(NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃时,pH=7是显中性的溶液,据此回答判断即可.
解答 解:(1)氯化铁水解呈酸性,Fe3++3H2O?Fe(OH)3+3H+,可使碳酸钙溶解,反应的方程式为CaCO3+2H+=Ca2++H2O+CO2↑,反应消耗H+,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;
故答案为:有无色无味气体生成; 溶液颜色变深或溶液为红褐色或久置有红褐色沉淀;Fe3++3H2O?Fe(OH)3+3H+、CaCO3+2H+=Ca2++CO2↑+H2O;
(2)在饱和氯化铁溶液中加入一种单质,也会发生类似上述现象的反应,平衡正向进行,且加入的物质和酸反应放出氢气,选项中AB是非金属单质不能和酸反应,铜是金属不能和稀酸反应,镁和溶液中稀酸反应生成氢气,促进平衡正向进行,生成氢氧化铁红褐色沉淀;
故答案为:C;
(3)酸或碱均抑制水的电离,电离呈酸性的酸式盐抑制水的电离,弱酸或弱碱的弱根离子水解,促进水的电离,0.1mol•L-1NaHCO3,NH4HCO3,NaHSO4,NaCl和氨水中的水的电离度分别为a1,a2,a3,a4,a5,1NaHCO3溶液中碳酸氢根离子水解促进水的电离,NH4HCO3,铵根离子和碳酸氢根离子水解相互促进,NaHSO4溶液中氢离子抑制水的电离,水的电离度由大到小的顺序,a2>a1>a4>a5 >a3,
故答案为:a2>a1>a4>a5 >a3;
(4)水的电离度之比等于溶液中水电离的氢氧根离子浓度之比,则在0.01mol/L盐酸中水电离的氢氧根离子浓度为10-12mol/L,则0.1mol/LNaR的溶液中水的电离的氢氧根离子浓度为10-12mol/L×108=10-4mol/L,所以0.1mol/LNaR的溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,所以pH=10;
故答案为:10;
(5)NH4)2SO4与NH3•H2O的混合溶液中存在电荷守恒:c (NH4+)+c(H+)=2c(SO42-)+c(OH-),25℃时,pH=7是显中性的溶液,故c(H+)=c(OH-),所以c(NH4+)=2c(SO42-),
故答案为:=.
点评 本题考查了弱电解质的电离、盐类的水解、溶液中离子浓度的比较等知识点,试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 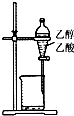 除去乙醇中的乙酸 | B. | 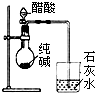 证明醋酸是弱酸 | ||
| C. | 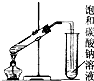 制取乙酸乙酯 | D. | 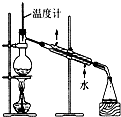 石油的分馏 |
| A. | 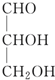 | B. | 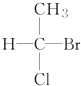 | C. | CH3CH2OH | D. | 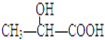 |
| A. | 加入适量的6mol/L的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
| A. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | B. | c(H+)<c(OH-) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=0.2mol/L |
| A. | 用新制的生石灰,通过加热蒸馏,可以除去乙醇中少量的水 | |
| B. | 用酸性高锰酸钾溶液,通过洗气的方法,可以除去甲烷中的乙烯 | |
| C. | 用苯,通过分液的方法,可以除去溴苯中的溴 | |
| D. | 用氢氧化钠溶液,通过分液的方法,可以除去乙酸乙酯中的乙酸 |
| A. | 1mol羟基(-OH)含有10NA个电子 | |
| B. | 在20gH218O中含有10NA个中子 | |
| C. | 标准状况下,22.4L四氯化碳含有NA个四氯化碳分子 | |
| D. | 1mol乙醇分子中含有共用电子对数目为7NA |
 大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )
大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )| A. | O+O3═2O2是吸热反应 | B. | O+O3═2O2是放热反应 | ||
| C. | 反应O+O3═2O2的△H=E3-E2 | D. | 反应O+O3═2O2的△H=E3-E1 |