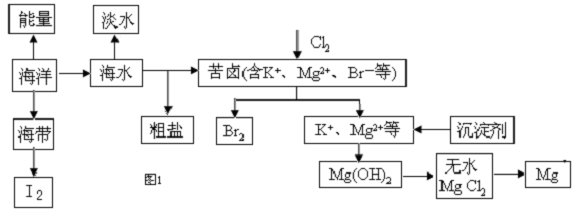
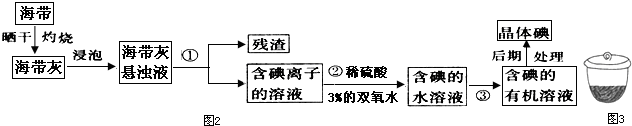
题目内容
11.瑞典皇家科学院2001年10月10日宣布,2001年诺贝尔化学奖授予在“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家.下列分子中不含有“手性碳原子”的是( )| A. | 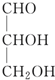 | B. | 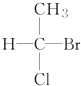 | C. | CH3CH2OH | D. | 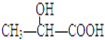 |
分析 根据手性碳原子指连有四个不同基团的碳原子,手性碳原子判断注意:(1)手性碳原子一定是饱和碳原子;(2)手性碳原子所连接的四个基团要是不同的.
解答 解:A.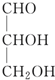 中间的碳原子连有的四个不同取代基,该碳原子具有手性,故A错误;
中间的碳原子连有的四个不同取代基,该碳原子具有手性,故A错误;
B. 底下的碳原子连有的四个不同取代基,该碳原子具有手性,故B错误;
底下的碳原子连有的四个不同取代基,该碳原子具有手性,故B错误;
C.CH3CH2OH中一个碳原子所连接的四个基团有3个是一样的,另一个碳原子所连接的四个基团有2个是一样的,碳原子没有手性,故C正确;
D.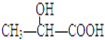 中间的碳原子连有的四个不同取代基,该碳原子具有手性,故D错误.
中间的碳原子连有的四个不同取代基,该碳原子具有手性,故D错误.
故选C.
点评 本题主要考查手性碳原子的判断,难度不大,手性碳原子判断注意:手性碳原子一定是饱和碳原子,手性碳原子所连接的四个基团要是不同的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.分子式为C6H12O2的有机物A,有香味,不能使紫色石蕊试液变红.A在酸性条件下水解生成有机物B和甲醇.则A可能的结构有( )
| A. | 1种 | B. | 3种 | C. | 4种 | D. | 多于4种 |
19.常温下,将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于( )
| A. | 2×10-10mol/L | B. | 12(10-8+10-10)mol/L | ||
| C. | (10-8+10-10)mol/L | D. | 12(10-6+10-4) |
6.由两种气态烃组成的混合气体,其所含碳元素和氢元素的质量之比为 24:3,则混合气体的组成及其体积比可能是( )
| A. | CH4和 C3H4,体积比为 1:1 | B. | C2H2和 C2H6,体积比为 3:1 | ||
| C. | C2H4和C2H6,体积比为 2:1 | D. | C2H2和 C2H4,体积比为 2:3 |
16.关于如图不正确的说法是( )
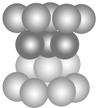

| A. | 此种堆积为面心立方最密堆积 | |
| B. | 该种堆积方式称为铜型 | |
| C. | 该种堆积方式可用符号…ABCABC…表示 | |
| D. | 该种堆积方式所形成晶胞中原子的空间占有率为68% |
3.鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子,其中有6个双键且不含环状结构,则其分子式为( )
| A. | C30H60 | B. | C30H56 | C. | C30H52 | D. | C30H50 |
6.已知β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质),下面是以锂辉矿为原料来制取金属锂的一种工艺流程.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.