题目内容
8.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的量,可采用的方法是( )| A. | 加入适量的6mol/L的盐酸 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
分析 过量的锌片,盐酸完全反应,则加快反应速率又不影响生成氢气的总量,可增大氢离子浓度或增大金属的接触面积、构成原电池等,不改变其氢离子物质的量即可,以此来解答.
解答 解:A.加入适量的6 mol•L-1的盐酸,反应速率加快,生成氢气增多,故A不选;
B.加入数滴氯化铜溶液,锌将铜置换出来形成原电池,反应速率加快,没有改变氢气的总量,故B选;
C.加入适量蒸馏水,浓度变小,反应速率减慢,故C不选;
D.加入适量的氯化钠溶液,反应速率减慢,故D不选;
故选:B.
点评 本题考查影响化学反应速率的因素,注意把握浓度、接触面积对反应速率的影响即可解答,注重基础知识的考查,注意Zn过量盐酸完全反应,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
18.一种用于制造隐形飞机的材料其主要成分的分子结构如图,它属于( )


| A. | 无机物 | B. | 烯烃 | C. | 高分子化合物 | D. | 有机化合物 |
19.常温下,将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于( )
| A. | 2×10-10mol/L | B. | $\frac{1}{2}$(10-8+10-10)mol/L | ||
| C. | (10-8+10-10)mol/L | D. | $\frac{1}{2}$(10-6+10-4) |
16.关于如图不正确的说法是( )
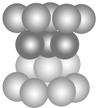

| A. | 此种堆积为面心立方最密堆积 | |
| B. | 该种堆积方式称为铜型 | |
| C. | 该种堆积方式可用符号…ABCABC…表示 | |
| D. | 该种堆积方式所形成晶胞中原子的空间占有率为68% |
3.鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子,其中有6个双键且不含环状结构,则其分子式为( )
| A. | C30H60 | B. | C30H56 | C. | C30H52 | D. | C30H50 |
13.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
| A. | 氯化镁 | B. | 碳酸氢铵 | C. | 硫酸钾 | D. | 亚硫酸 |