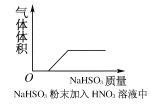
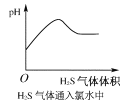
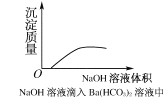
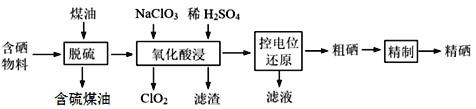
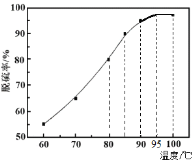
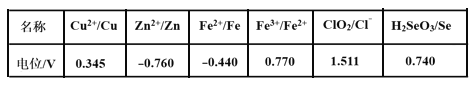
题目内容
【题目】下列有关盐类水解的事实或应用、解释的说法不正确的是( )
事实或应用 | 解释 | |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 泡沫灭火器灭火 | Al2(SO4)3与NaHCO3溶液反应产生CO2气体 |
C | 施肥时,草木灰(主要成为K2CO3)与NH4Cl不能混合使用 | K2CO3与NH4Cl反应生成NH3,降低肥效 |
D | 明矾[KAl(SO4)2·12H2O]作净水剂 | 明矾溶于水生成Al(OH)3 胶体 |
A.AB.BC.CD.D
【答案】A
【解析】
A.用热的纯碱溶液去除油污,其原因是Na2CO3水解使溶液显碱性,油脂在碱性溶液中发生水解生成高级脂肪酸钠和甘油,并非纯碱与油污直接发生反应,故A错误;
B.泡沫灭火器灭火的原理是利用Al2(SO4)3与NaHCO3溶液发生相互促进的水解反应:Al3++3HCO![]() ===Al(OH)3↓+3CO2↑,生成CO2气体,故B正确;
===Al(OH)3↓+3CO2↑,生成CO2气体,故B正确;
C.K2CO3是弱酸强碱盐,NH4Cl是强酸弱碱盐,混合使用时,二者发生相互促进的水解反应生成NH3,降低肥效,故C正确;
D.明矾溶于水电离产生的Al3+水解生成Al(OH)3胶体,Al(OH)3胶体能吸附水中悬浮的杂质,从而起到净水作用,故D正确。
答案选A。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】已知几种盐溶液的pH如表所示:
① | ② | ③ | |
均为0.1 mol·L-1溶液 | NaHCO3 | Na2CO3 | NaClO |
常温下溶液pH | 9.7 | 11.6 | 10.3 |
下列说法正确的是
A.三种溶液中水的电离程度:①>③>②
B.每种溶液都只存在1种微粒的电离平衡
C.①与②中均存在:c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+)
D.向NaClO溶液中通入少量CO2的反应为ClO-+CO2+H2O=HClO+HCO3-
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
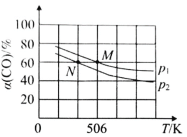
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
A.容器内压强保持不变 B.2v正
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。