题目内容
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
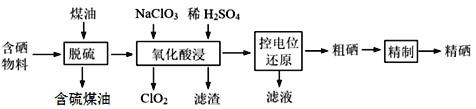
回答下列问题:
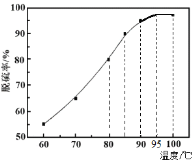
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。
(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为_____________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
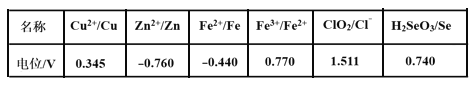
①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(S2-)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为________ %,与粗硒中铁含量为0.89%相比,铁含量明显降低。
【答案】温度升高,单质硫在煤油中的溶解度增加 95℃ 4ClO3-+ 4H+ + Se=4ClO 2↑+ H2O + H2SeO3 ClO2 + 4H+ + 5e-=Cl- + 2H2O 0.345 5.0×10-35 mol·L-1 Na2SeSO3 + H2SO4=Na2SO4 + Se↓+ SO2↑+ H2O 3.2×10-3
【解析】
(1)结合含硒物料的成分和脱硫率随温度的变化图分析;
(2)“氧化酸浸”中,Se在酸性条件下,与氯酸钠发生氧化还原反应转化成H2SeO3;
(3)①根据表格数据,控制电位在0.740~1.511V范围内,ClO2被还原为Cl-;
②结合题意,根据“氧化酸浸”液中主要粒子的电位表数据,分析使硒和杂质金属分离最低电位;
(4) ①利用溶度积表达式Ksp(CuS)= c(S2-) c(Cu2+),结合已知条件计算;
②根据精制流程,硒代硫酸钠与硫酸发生氧化还原反应转化为硒单质;
(5)根据1g精硒中铁含量来计算铁的质量分数。
(1)含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)中含有硫单质,向物料中加入煤油,硫转移到煤油中,说明硫易溶于煤油,结合脱硫率随温度的变化图曲线变化,温度越高,硫单质在煤油中的溶解度越大,且温度控制在95℃脱硫率最高;
(2)“氧化酸浸”中,Se在酸性条件下,与氯酸钠发生氧化还原反应转化成H2SeO3,离子反应方程式为:4ClO3-+ 4H+ + Se=4ClO 2↑+ H2O + H2SeO3;
(3)①根据表格数据,控制电位在0.740~1.511V范围内,在酸性条件下,ClO2得电子被还原为Cl-,该过程的还原反应(半反应)式为:ClO2+4H++5e-=Cl-+2H2O;
②根据题意,电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离,结合“氧化酸浸”液中主要粒子的电位表数据,金属离子的电位都低于0.345,要使硒与杂质金属的分离,最低电位要不低于0.345;
(4) ①已知:c(S2-)=0.026 mol·L-1,Ksp(CuS)=c(S2-)·c(Cu2+)=1.3×10-36,c(Cu2+)= 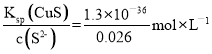 =5.0×10-35 mol·L-1;
=5.0×10-35 mol·L-1;
②根据精制流程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4,硒代硫酸钠与硫酸发生氧化还原反应转化为硒单质,化学方程式为:Na2SeSO3 + H2SO4=Na2SO4 + Se↓+ SO2↑+ H2O;
(5)设精硒的质量为1g,则1g精硒中含有的铁的质量=32 μg·g-1×1g=32μg=3.2×10-5g,则精硒中铁的质量分数=![]() =3.2×10-3%。
=3.2×10-3%。

【题目】下列有关盐类水解的事实或应用、解释的说法不正确的是( )
事实或应用 | 解释 | |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 泡沫灭火器灭火 | Al2(SO4)3与NaHCO3溶液反应产生CO2气体 |
C | 施肥时,草木灰(主要成为K2CO3)与NH4Cl不能混合使用 | K2CO3与NH4Cl反应生成NH3,降低肥效 |
D | 明矾[KAl(SO4)2·12H2O]作净水剂 | 明矾溶于水生成Al(OH)3 胶体 |
A.AB.BC.CD.D