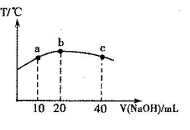
题目内容
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为 。
(2)N、P、As原子的第一电离能由大到小的顺序为 。
(3)NH3的沸点比PH3高,原因是 ;PO43-离子的立体构型为 。
(4)PH3分子中P原子采用 杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
(1)1s22s22p63s23p63d104s24p3 (2)N>P>As
(3)NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力 正四面体
(4)sp3杂化
(5)H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中的As为+5价,正电性更高,导致As-O-H中O的电子更向As偏移,更易电离出H+
(6)16mol或16×6.02×1023个
解析
试题分析:(1)根据能级填充顺序图可知33号元素砷的基态原子的电子排布式为1s22s22p63s23p63d104s24p3 。(2)N、P、As是第ⅤA的元素,原子半径逐渐增大,元素的非金属性逐渐减弱。元素的非金属性弱,原子的第一电离能就越小。所以这三种元素的第一电离能由大到小的顺序为N>P>As。(3)N、P是同一主族的元素,形成的化合物结构相似。一般来说,对于结构相似的物质来说,相对分子质量越大,分子间作用力就越大。物质的熔沸点就越高。但是由于N元素的非金属性很强,原子半径又较小,所以在NH3的分子之间还存在着氢键,增加了分子之间的相互作用,克服它需要消耗较高的能力,而PH3分子间仅有较弱的范德华力。所以NH3的沸点比PH3高。PO43-离子的立体构型为正四面体型。(4)PH3分子中P原子采用sp3杂化,三个共用电子对及P原子上的孤对电子各占据一个。(5)H3AsO4和H3AsO3是砷的两种含氧酸, H3AsO4和H3AsO3可表示为(HO)3AsO和(HO)3As,H3AsO3中的As为+3价,而H3AsO4中的As为+5价,正电性更高,导致As-O-H中O的电子更向As偏移,更易电离出H+所以H3AsO4比H3AsO3酸性强。(6)配合物[Cu(NH3)4]Cl2是离子化合物。在阳离子[Cu(NH3)4]2+中四个NH3通过配位键与Cu2+结合,在每个NH3中含有3个共价键,所以在阳离子[Cu(NH3)4]2+中含有的共价键为3×4+4=16.因此1mol该配合物中含有σ键的数目为16mol.。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
(1)在这些元素中,金属性最强的元素是
(2)化学性质最不活泼的元素其原子结构示意图为 ;
(3)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。

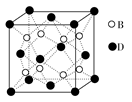

 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。