题目内容
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
(1)在这些元素中,金属性最强的元素是
(2)化学性质最不活泼的元素其原子结构示意图为 ;
(3)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
(1)K
(2)
(3)HClO4,KOH,Al(OH)3
(4)Na ,Cl ;(5)Cl2,2NaBr+Cl2=2NaCl+Br2
解析试题分析:(1)同周期的元素,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强。从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。所以金属性最强的 元素是⑨元素K。(2)对于惰性气体元素来说,原子的最外层达到了2个或8个电子的稳定结构,化学性质最不活泼。所以化学性质最不活泼的元素是⑧元素Ar.其原子结构示意图为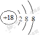 .(3)在表格中元素的非金属性最强的是②元素F。但其没有含氧酸。在其余的元素中,非金属性最强的是⑦元素Cl,它的最高价氧化物对应的水化物中酸性最强的是HClO4。金属性最强的元素是⑨元素K。元素的金属性越强,其对应的最高价氧化物的水化物碱性最强。所以碱性最强的是KOH。Al(OH)3既能与酸反应生成盐和水,也能与碱反应生成盐和水。是两性氢氧化物。因此呈两性的氢氧化物是Al(OH)3。(4)③~⑦元素是同一周期的元素,从左到右,随着原子序数的增大,原子半径逐渐减小。所以原子半径最大的是Na,原子半径最小的是Cl。(5)⑦元素的单质Cl2与⑩元素的单质Br2,元素的非金属性越强,元素相应的单质的氧化性就越强。由于非金属性Cl>Br。所以单质化学性质较活泼的是Cl2。活动性强的元素的单质能把活动性弱的从化合物中置换出来。Cl2+2NaBr=2NaCl+Br2.
.(3)在表格中元素的非金属性最强的是②元素F。但其没有含氧酸。在其余的元素中,非金属性最强的是⑦元素Cl,它的最高价氧化物对应的水化物中酸性最强的是HClO4。金属性最强的元素是⑨元素K。元素的金属性越强,其对应的最高价氧化物的水化物碱性最强。所以碱性最强的是KOH。Al(OH)3既能与酸反应生成盐和水,也能与碱反应生成盐和水。是两性氢氧化物。因此呈两性的氢氧化物是Al(OH)3。(4)③~⑦元素是同一周期的元素,从左到右,随着原子序数的增大,原子半径逐渐减小。所以原子半径最大的是Na,原子半径最小的是Cl。(5)⑦元素的单质Cl2与⑩元素的单质Br2,元素的非金属性越强,元素相应的单质的氧化性就越强。由于非金属性Cl>Br。所以单质化学性质较活泼的是Cl2。活动性强的元素的单质能把活动性弱的从化合物中置换出来。Cl2+2NaBr=2NaCl+Br2.
考点:考查元素周期表、元素周期律的应用的知识。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W在元素周期表中的位置为 ;X、Y、Z、W四种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为 ;B的电子式为 。化合物ZY中存在的化学键类型为 。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物对应的水化物的化学式为 。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 。检验溶液中R3+常用的试剂是 ,可以观察到的现象是 。
(5)Z
 W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为 。 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分 子X,X的水溶液呈碱性 |
| D | 其简单阳离子与X具有相同电子数,且是同周 期中简单阳离子中半径最小的 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
则:(1)B的原子结构示意图为 。
(2)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(3)C与D形成的化合物的化学式是 ,它的性质决定了它在物质的分类中应属于 ;请写出该化合物对应水化物电离的方程式 。
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式 。
 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。 。
。 