题目内容
已知钾原子的原子结构示意图为:(如图所示)
(1)钾元素的原子序数为:
(2)钾元素的原子在反应中易 (填“得到”或“失去”) 个电子,表现出 性(填“氧化性”或“还原性”)
(3)钾元素的金属性 (填“强”或“弱”)于钠元素的金属性。
(1)19
(2)失去、1、还原性
(3)强
解析试题分析:(1)钾元素的原子序数等于原子的核外电子数19
(2)钾元素的原子的最外层电子是1个,在反应中易失去1个电子,表现出还原性
(3)钾与钠同主族,钾比钠多一个电子层,所以钾元素的金属性强于钠元素的金属性。
考点:考查元素的原子结构与性质的关系

练习册系列答案
相关题目
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
| 元素 | 信息 |
| B | 其单质在常温下为双原子分子,与A可形成分 子X,X的水溶液呈碱性 |
| D | 其简单阳离子与X具有相同电子数,且是同周 期中简单阳离子中半径最小的 |
| E | 元素原子最外层比次外层少2个电子 |
| C、F | 两种元素的原子最外层共有13个电子 |
则:(1)B的原子结构示意图为 。
(2)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(3)C与D形成的化合物的化学式是 ,它的性质决定了它在物质的分类中应属于 ;请写出该化合物对应水化物电离的方程式 。
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式 。
(1)可正确表示原子轨道的是 。
| A.2s | B.2d | C.2px | D.3f |
(3)下列物质变化,只与范德华力有关的是 。
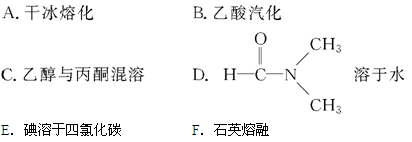
(4)下列物质中,只含有极性键的分子是 ,既含离子键又含共价键的化合物是 ;只存在σ键的分子是 ,同时存在σ键和π键的分子是 。
AN2;BCO2;CCH2Cl2;DC2H4;EC2H6;FCaCl2;GNH4Cl
(5)用“>”、“<”或“=”填空:
第一电离能的大小:Mg Al;熔点的高低:KCl MgO。
部分中学化学常见元素原子结构及性质如表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱_____________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_________________________________________________________________。

 。
。