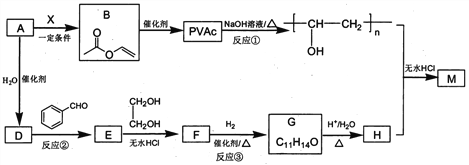
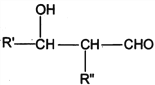
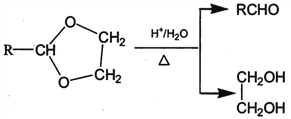
题目内容
【题目】下列说法正确的是
A. 铜在自然界中主要以单质的形式存在
B. 工业上常用电解饱和食盐水的方法制备金属钠
C. 工业上常用焦炭在高温下直接将氧化铁还原炼铁
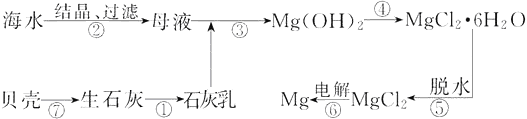
D. 在海水中加入石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法
【答案】D
【解析】
A、自然界中铜以化合态形式存在,故A错误;B. 电解饱和食盐水发生反应2NaCl + 2H2O![]() 2NaOH + Cl2↑+ H2↑,不能得到金属钠,应该电解熔融状态的氯化钠,故B错误;C、高温下,碳被氧化为二氧化碳,二氧化碳和C反应生成CO,所以高炉炼铁的主要反应原理是CO在高温下将氧化铁还原成铁,故C错误;D.海水中镁离子的浓度较低,在海水中加入石灰乳可得氢氧化镁沉淀,实现了镁的富集,故D正确;故选D。
2NaOH + Cl2↑+ H2↑,不能得到金属钠,应该电解熔融状态的氯化钠,故B错误;C、高温下,碳被氧化为二氧化碳,二氧化碳和C反应生成CO,所以高炉炼铁的主要反应原理是CO在高温下将氧化铁还原成铁,故C错误;D.海水中镁离子的浓度较低,在海水中加入石灰乳可得氢氧化镁沉淀,实现了镁的富集,故D正确;故选D。

【题目】为测定铝热反应实验所得“铁块”的成分,某学生兴趣小组设计实验流程如图所示。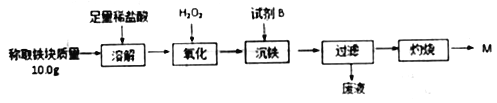
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
(1)取溶解操作得到的溶液,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的氧化铁外,还有一个原因是_______________。
(2)沉铁操作应调节溶液pH的范围的为________,试剂B 选择______。(填序号)
a.稀盐酸 b.氧化铁 c.MgCO3固体 d.氨水
(3)已知常温下Fe(OH)3的Ksp=1.1×10-36,则铁完全沉淀时溶液中c(Fe3+)=_____mol/L。
(4)根据流程得到的固体M质量_____(填“能”或“不能”)计算出铁块中金属铁的质量,原因是________________。
(5)另有小组采用滴定的方式测定“铁块”中铁的含量(铁元素只存在Fe和Fe2O3),测定方式如下:
I.取10g“铁块”粉碎,加入足量氢氧化钠溶液充分反应,过滤、洗涤、干燥,得到8.88g固体。将固体加入足量盐酸溶解,获得200mL溶液A;
II.取出10mL 溶液A 于锥形瓶,先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+;
III.加入一定量的硫酸和磷酸,并滴加指示剂。再向锥形瓶中滴加0.1000mol/LK2Cr2O7溶液,恰好完全反应时,共消耗12.50mL K2Cr2O7溶液。发生反应:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
①步骤I中加入足量氢氧化钠溶液的作用为________________________。
②请计算样品中Fe单质的质量分数__________(写出计算过程)。