题目内容
【题目】根据下面图示回答问题:
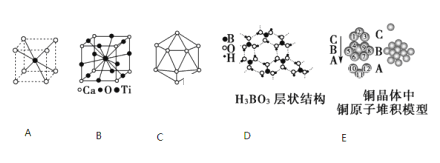
(1)A图是某离子化合物的晶胞,阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是________。
(2)B图若Ca、Ti、O形成的某钙钛矿型晶体结构如B图,其化学式为________。
(3)原子晶体硼的基本结构单元都是由硼原子组成的正二十面体,如C图。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察该图,推断这个基本结构单元所含硼原子个数、键角、B—B键的个数依次为________、________、_______。
(4)图D所示的物质结构中最外层已达8电子结构的原子是________(填元素符号),H3BO3晶体中B原子个数与极性键个数比为________;
(5)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用“________”理论;
【答案】 1∶1 CaTiO3 12 60° 30 O 1∶6 电子气
【解析】(1)阳离子数=1,阴离子数=8×![]() =1,即:阳离子数∶阴离子数=1∶1;正确答案:1:1。
=1,即:阳离子数∶阴离子数=1∶1;正确答案:1:1。
(2) 根据晶胞结构可知:Ca粒子个数为8×1/8=1, O粒子个数为12×1/4=3, Ti粒子个数为1,所以 Ca、Ti、O形成的某钙钛矿型晶体,其化学式为CaTiO3;正确答案:CaTiO3。
(3) 根据原子晶体硼的基本结构可知:B原子数=20×3×![]() =12,等边三角形的键角为60°,B—B键数=20×3×
=12,等边三角形的键角为60°,B—B键数=20×3×![]() =30;正确答案:12;60°;30 。
=30;正确答案:12;60°;30 。
(4) H3BO3中B原子最外层共6个电子,H原子达到2电子稳定结构,只有氧原子形成两个键达到8电子稳定;H3BO3晶体是分子晶体,相互之间通过氢键相连,每个B原子形成三条B-O极性共价键,每个O原子形成一条O-H极性共价键,共6条极性键,H3BO3晶体中B原子个数与极性键个数比为1:6;正确答案:O ;1∶6。
(5) “电子气”理论把金属键描述为金属原子脱落下来的价电子形成整块晶体的电子气,被所有原子所共用,从而把所有的原子联系在一起,可以用来解释金属键的本质,金属的延展性、导电性、传热性;正确答案:电子气。