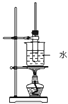
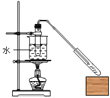
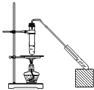
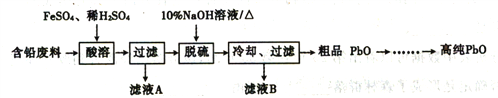
题目内容
【题目】下列解释中,不正确的是![]()
A. 水在结冰时体积膨胀,是由于水分子中存在分子间氢键
B. 水很稳定![]() 以上才会部分分解
以上才会部分分解![]() 是因为水中含有大量的氢键所致
是因为水中含有大量的氢键所致
C. MgO的熔点比![]() 高主要是因为MgO的晶格能比
高主要是因为MgO的晶格能比![]() 大
大
D. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
【答案】B
【解析】A.在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,故A正确;B.水很稳定,是因为水分子内的共价键较强的缘故,与氢键无关,氢键只影响水的熔沸点,故B错误;C.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与离子电荷成正比,氧离子半径小于氯离子半径,且氧离子所带电荷大于氯离子所带电荷,所以氧化镁晶格能大于氯化镁,则MgO的熔点比MgCl2高,故C正确;D.碘、四氯化碳、甲烷均是非极性分子,而水是极性溶剂,根据相似相溶原理知,碘易溶于四氯化碳,甲烷难溶于水,故D正确;故选B。

练习册系列答案
相关题目