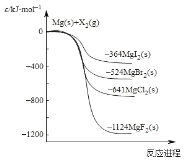
题目内容
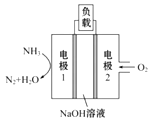
【题目】电解原理在化学工业中有着广泛的应用。如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同,A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:
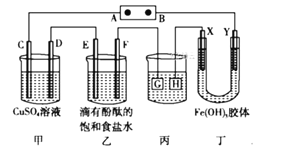
(1)外接直流电源中A为____极,甲中电解时的化学反应方程式为__________,通过一段时间后向所得溶液中加入0.2molCu(OH)2粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为______________。
(2)现用丙装置给铜件镀银,H为______(填“镀件”还是“镀层”),当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________。
(3)电解一段时间后,发现丁中Y极附近溶液红褐色加深,则Fe(OH)3胶粒带____(填“正”或“负”)电荷。
【答案】正 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 0.8mol 镀件 5.4g 正
2Cu+O2↑+2H2SO4 0.8mol 镀件 5.4g 正
【解析】
将直流电源接通后,F极附近呈红色,可知道氢离子在该电极放电,所以F是阴极,E是阳极,则电源电极A是正极,B是负极,并得到其他各个电极的名称,在同一串联电路中电子转移数目相等,结合电镀要求判断镀件、镀层;对于Fe(OH)3胶体来说,胶粒带正电荷,会向负电荷较多的电极方向移动,据此分析解答。
将直流电源接通后,F极附近呈红色,说明F极显碱性,是溶液中H+在该电极放电,所以F电极是阴极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极,A是电源的正极,B是负极。
(1)根据上述分析可知:A是电源正极,B是电源的负极,在甲中,C是阳极,D是阴极。在该溶液中阴离子有OH-、SO42-,放电能力:OH->SO42-, C电极发生反应:4OH--4e-=O2↑+2H2O;阳离子有Cu2+、H+,放电能力Cu2+>H+,所以在D电极发生反应:Cu2++2e-=Cu,电解时总反应方程式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+,电解的化学反应方程式为2CuSO4+2H2O
2Cu+O2↑+4H+,电解的化学反应方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,通电后加入0.2molCu(OH)2(相当于CuO和H2O)后溶液与电解前相同,根据铜元素守恒,所以析出金属铜的物质的量是0.2mol,阴极反应是:2Cu2++4e-→2Cu,当析出金属铜的物质的量是0.2mol时,则转移的电子是0.4mol,当电解掉0.2mol水时,转移电子是0.4mol,总共转移电子是0.8mol;
2Cu+O2↑+2H2SO4,通电后加入0.2molCu(OH)2(相当于CuO和H2O)后溶液与电解前相同,根据铜元素守恒,所以析出金属铜的物质的量是0.2mol,阴极反应是:2Cu2++4e-→2Cu,当析出金属铜的物质的量是0.2mol时,则转移的电子是0.4mol,当电解掉0.2mol水时,转移电子是0.4mol,总共转移电子是0.8mol;
(2)电镀装置中,镀层金属必须作阳极连接电源的正极,镀件作阴极,连接电源的负极,所以丙装置中H应该是镀件,G是镀层金属。当乙中溶液的pH是13时(此时乙溶液体积为500mL)时,根据电极反应2H++2e-=H2↑,则放电的氢离子的物质的量为:0.1mol/L×0.5L=0.05mol,转移电子的物质的量为0.05mol电子时,丙中镀件上析出银的质量m(Ag)= 0.05mol× 108g/mol=5.4g;
(3)电源B电极为负极,则Y电极为阴极,阴极上负电荷较多,电解一段时间后,发现丁中Y极附近溶液红褐色加深,根据同种电荷相互排斥,异种电荷相互吸引的原则,说明Fe(OH)3胶粒带正电荷。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案