题目内容
【题目】回答下列问题
(1)已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3,则Co3O4与浓盐酸反应能生成黄绿色气体的离子方程式_________________。
(2)碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
已知25℃,101kPa时: 4Fe(s)+3O2(g)=2Fe2O3(s) △H=1648kJ/mol
C(s)+O2(g)=CO2(g) △H=393kJ/mol
2FeCO3(s)=2Fe(s)+2C(s)+3O2(g) △H=+1480kJ/mol
写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式______________。
(3)将标准状况下1.344L Cl2通入100mL0.5mol/lFeI2溶液中的离子方程式为_____________。
(4)1mol·L-1的NaAlO2溶液和3.0mol·L-1的HCl溶液等体积混合的离子方程式为________________
(5)用于驱动潜艇的液氨-液氧燃料电池示意图如图所示:
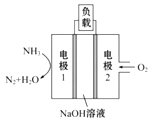
则电极1的电极反应式为:______________。
【答案】Co3O4+8H++2Cl-=3Co2++Cl2↑+4H2O 4FeCO3(s)+O2(g) =2Fe2O3(s)+4CO2(g) △H=-260kJ/mol 6Cl2+10I-+2Fe2+=12Cl-+5I2+2Fe3+ 3AlO2-+9H+=Al(OH)3↓+2Al3++3H2O 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,据此回答;
(2)FeCO3在空气中煅烧生成Fe2O3、CO2,将已知热化学方程式叠加,可得该反应的热化学方程式;
(3)先计算Cl2的物质的量,然后利用还原性I->Fe2+,根据微粒的物质的量多少,还原性强的先反应,然后是还原性弱的后反应,书写离子方程式;
(4)二者的物质的量比为1:3,转化为沉淀时以1:1反应,沉淀溶解时,沉淀与酸以1:3反应,生成铝离子;
(5)该装置是原电池,在电极1上NH3失去电子,发生氧化反应,结合溶液中的OH-书写电极反应式。
(1)Co3O4与浓盐酸反应,能生成黄绿色气体氯气,同时得到还原产物氯化钴,发生反应的离子方程式为:Co3O4+8H++2Cl-=3Co2++Cl2↑+4H2O;
(2)在空气中加热FeCO3可以和氧气反应得到黑色Fe2O3,即4FeCO3+O2![]() 2Fe2O3+4CO2,
2Fe2O3+4CO2,
①4Fe(s)+3O2(g)=2Fe2O3(s) △H1=1648kJ/mol
②C(s)+O2(g)=CO2(g) △H2=393kJ/mol
③2FeCO3(s)=2Fe(s)+2C(s)+3O2(g) △H3=+1480kJ/mol
①+4×②+2×③,整理可得4FeCO3(s)+O2(g) =2Fe2O3(s)+4CO2(g) △H=△H1+4×△H2+2×△H3=-260kJ/mol;
(3)n(Cl2)= 1.344L÷22.4L/mol=0.06mol,n(FeI2)=c·V=0.5mol/L×0.1L=0.05mol,n(Fe2+)=0.05mol,n(I-)=2n(FeI2)=0.1mol,由于还原性:I->Fe2+,首先发生反应:Cl2+2I-=2Cl-+I2,0.1molmolI-反应消耗0.05molCl2,还剩余0.01molCl2,发生反应Cl2+2Fe2+=2Cl-+Fe3+,0.01molCl2反应消耗0.02molFe2+,所以反应的离子方程式为6Cl2+10I-+2Fe2+=12Cl-+5I2+2Fe3+;
(4)假设溶液的体积为3L,则溶液中含有n(NaAlO2)=3.0mol,n(HCl)=9.0mol,首先发生反应:
AlO2-+H++H2O=Al(OH)3↓,AlO2-反应完全,H+消耗3mol,产生3mol Al(OH)3,还剩余6mol,发生反应:Al(OH)3+3H+=Al3++3H2O,6molH+反应会消耗2mol Al(OH)3,产生2mol Al3+,剩余1mol Al(OH)3,则1mol·L-1的NaAlO2溶液和3.0mol·L-1的HCl溶液等体积混合的离子方程式为3AlO2-+9H+=Al(OH)3↓+2Al3++3H2O;
(5)在电极1上NH3失去电子,变为N2,则电极1的电极反应式为2NH3-6e-+6OH-=N2+6H2O。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案