题目内容
【题目】25℃时向20mL 0.1mol·L-1醋酸溶液中不断滴入0.1mol·L-1NaOH(aq),溶液pH变化如图所示。此过程里溶液中离子浓度的关系错误的是( )
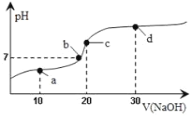
A.a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b点:c(Na+) = c(CH3COO-)>c(H+) = c(OH-)
C.c点:c(H+) = c(CH3COO-) + c(OH-)
D.d点:c(Na +)>c(OH-) >c(CH3COO-)>c(H+)
【答案】CD
【解析】
A. a点为等物质的量的CH3COOH、CH3COONa形成的溶液,根据图像溶液显酸性,CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COO-)>c(Na+),醋酸为弱酸,少量电离,则c(Na+)>c(H+)>c(OH-),A正确;
B. b点为中性溶液,则c(H+) = c(OH-),根据溶液呈电中性,c(Na+) +c(H+) = c(CH3COO-)+ c(OH-),则c(Na+)= c(CH3COO-),溶液中的c(Na+) c(H+),B正确;
C. c点为CH3COONa溶液,溶液呈碱性,应有c(H+)<c(OH-),C错误;
D. d点为NaOH和CH3COONa的混合物,且2c(NaOH)=c(CH3COONa),溶液呈碱性,醋酸根离子水解但水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
答案为CD。

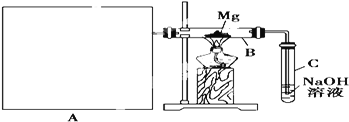
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间隙法”制取,反应原理、实验装置图(加热装置都已略去)如下:![]()

已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是___________,冷凝管中冷水应从______(填“a”或“b”) 处通入。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是_________(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、________和________;
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:_____________________;_________________;(写两个即可)
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是________________;
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则lt苯可制得成品为________________t(只要求列式)。
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL 0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 20.02 | 20.00 |
2 | 0.1000 | _______ | 20.00 |
3 | 0.1000 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为__________g,配制标准溶液需要用到玻璃棒、烧杯外,还需要的玻璃仪器有__________________。
(2)步骤二中量取20.00mL的稀盐酸用到的仪器是__________。判断滴定终点的现象是_____
(3)实验2,滴定前液面在“0”刻度处,滴定后液面如图所示,其读数为________mL。根据上述数据,可计算出该盐酸的浓度为__________。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有(_______)
A. 配制标准溶液定容时,仰视刻度线
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失