题目内容
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
【答案】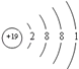
![]() NH3、CH4、H2S 5 1 NH4HS或(NH4)2S [Cu(NH3)4]SO4 内界中铜离子与氨分子之间以配位键相结合,外界铜氨络离子与硫酸根离子之间以离子键相结合
NH3、CH4、H2S 5 1 NH4HS或(NH4)2S [Cu(NH3)4]SO4 内界中铜离子与氨分子之间以配位键相结合,外界铜氨络离子与硫酸根离子之间以离子键相结合
【解析】
由于A,B,C,D为短周期元素,因A元素的周期数、主族数、原子序数相同,则A只能为氢元素;同一能层的不同能级的能量不同,符号相同的能级处于不同能层时能量也不同,即1s、2s、2p的轨道能量不同,2p有3个能量相同的轨道,由此可确定B;因s轨道最多只能容纳2个电子,所以c=2,即C原子价电子构型为2s22p3,即氮元素。短周期中原子的次外层只可能是K或L层,K、L层最多容纳2个或8个电子,据此可确定D。再由D的阴离子电子数及在E2D中E的化合价,即可确定E。由此分析。
由于A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同,则A为氢元素;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同,则B的电子排布式为1s22s23p2,即B为碳元素;因s能级最多只能容纳2个电子,即c=2,所以C原子价电子构型为2s22p3,C为氮元素;短周期中原子的次外层只可能是K或L层,K、L层最多容纳2个或8个电子,因D原子最外层电子数比次外层电子数少2个,所以D的次外层只能是L层,D的最外层应为6个电子,即D为16号元素硫;硫元素的阴离子(S2-)有18个电子,E阳离子也应有18个电子,在E2D中E显+1价,所以E为19号元素钾。所以A、B、C、D、E分别为氢、碳、氮、硫、钾。
(1)上述五种元素中金属性最强的是钾元素,故它的第一电离能最小,其原子结构示意图为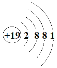 。硫原子价电子层为M层,价电子排布式为3s23p4,其电子排布图为
。硫原子价电子层为M层,价电子排布式为3s23p4,其电子排布图为![]() 。
。
(2)①分子结构图中黑点表示的原子最外层有5个电子,显然是氮原子,白球表示的原子最外层只有1个电子,是氢原子,所以该分子是NH3,中心N原子有3个σ键,1个孤电子对,故采用sp3杂化;②分子中黑球表示的原子最外层4个电子,是碳原子,白球表示的原子的最外层只有1个电子,是氢原子,所以②分子是CH4,中心碳原子有4个σ键,0个孤电子对,采用sp3杂化;③分子中黑球表示的原子最外层4个电子,是碳原子,白球表示的原子的最外层只有1个电子,是氢原子,所以③分子是CH2=CH2,中心碳原子有3个σ键,0个孤电子对,所以中心原子采用sp2杂化;④分子中黑球表示的原子最外层6个电子,是硫原子,白球表示的原子的最外层只有1个电子,是氢原子,该分子为H2S,中心S原子有2个σ键,2个孤电子对,所以中心原子采用sp3杂化。因此中心原子采用sp3杂化形成化学键的分子有NH3、CH4、H2S。在CH2=CH2的分子中有5个σ键和1个π键。
(3)根据上面的分析知A、C、D分别为氢、氮、硫三种元素,形成既具有离子键又具有共价键的化合物是硫氢化铵或硫化铵,其化学式为NH4HS或(NH4)2S,铵根与HS-或S2-之间是离子键,铵根中的N与H之间是共价键,HS-中H与S之间是共价键。C的氢化物是NH3,NH3的水溶液与CuSO4溶液反应生成的配合物是硫酸四氨合铜,其化学式为[Cu(NH3)4]SO4。配合物[Cu(NH3)4]SO4的内界中Cu2+与NH3之间是以配位键相结合,外界铜氨配离子[Cu(NH3)4]2+与硫酸根离子之间是以离子键相结合。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案






