题目内容
1.(1)下列五种物质中①Ne ②H2O ③NH3④KOH ⑤Na2O,只存在共价键的是②③,只存在离子键的是⑤,既存在共价键又存在离子键的是④,不存在化学键的是①.(填写序号)(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是①⑤,仅发生离子键破坏的是②③,仅发生共价键破坏的是④.(填写序号)
分析 (1)共价键为非金属原子之间形成的化学键,离子键为阴阳离子之间形成的化学键,根据物质的组成进行判断;
(2)根据物质含有的化学键类型以及变化类型进行判断.
解答 解:(1)①Ne为单原子分子,不存在化学键;
②H2O为非金属原子之间形成的化学键,只存在共价键;
③NH3为非金属原子之间形成的化学键,只存在共价键;
④KOH为离子化合物,既存在共价键又存在离子键;
⑤Na2O为离子化合物,只存在离子键,
故答案为:②③;⑤;④;①;
(2)①碘为分子晶体,升华时克服分子间作用力,没有化学键发生变化,
②烧碱为离子晶体,含有离子键和共价键,融化时离子键断裂,而共价键没有变化,
③MgCl2为离子化合物,溶解于水没有发生化学变化,只发生离子键断裂;
④氯化氢为共价化合物,只含有共价键,溶解于水没有发生化学变化,只发生共价键断裂,
⑤O2溶于水,克服分子间作用力,没有破坏化学键,
故答案为:①⑤;②③;④.
点评 本题考查化学键的类型以及变化时的化学键的变化,为高频考点,侧重于基本概念的考查,注意物理变化与化学变化的区别,以及化学键与分子间作用力的区别.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
11.下列说法错误的是( )
| A. | 化学反应速率越快,反应现象越明显 | |
| B. | 需要加热才能进行的化学反应不一定是吸热反应 | |
| C. | 仅由非金属元素组成的化合物中可能含离子键 | |
| D. | ⅠA族金属元素是同周期中金属性最强的元素 |
12.对于结构简式为如图的烃,下列说法正确的是( )
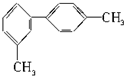

| A. | 分子中至少有6个碳原子处于同一平面上 | |
| B. | 分子中至少有8个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 分子中至少有14个碳原子处于同一平面上 |
16.向100mL 18mol•L-1的H2SO4溶液中加入适量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
| A. | 小于0.90 mol | B. | 等于0.90 mol | ||
| C. | 在0.90~1.80 mol之间 | D. | 大于0.90 mol |
13.下列有关实验及现象、原理的描述正确的是( )
| A. | 光照条件下,甲烷通入氯水中,发生了取代反应使黄绿色变浅 | |
| B. | 乙烯能使酸性高锰酸钾溶液褪色,也能使溴水褪色,两者反应原理一样 | |
| C. | 乙醛与新制氢氧化铜溶液混合好后,加热,得到砖红色沉淀 | |
| D. | 将一小粒钠投入盛有无水乙醇的小烧杯中,有气泡产生,比钠在水中的反应更剧烈 |
10.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| B. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐 | |
| D. | 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚 |
11.恒容密闭容器中进行的可逆反应2NO2(g)?2NO(g)+O2(g),不能说明该反应达到平衡状态的是( )
| A. | 单位时间内生成n mo1 O2的同时生成2n mol NO2 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | 混合气体的密度不再改变的状态 |
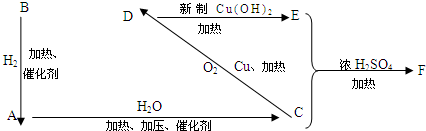
 CH3COOCH2CH3+H2O,反应类型是取代反应.
CH3COOCH2CH3+H2O,反应类型是取代反应. ,反应类型是加聚反应.
,反应类型是加聚反应.
 .
.