题目内容
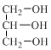
【题目】(1)写出石英主要成分的化学式:_____________;写出异丁烷的结构简式:_____________
(2)联氨(又称为肼,分子式为N2H4)一种高能燃料,常备用于火箭、航天领域,通常用过量NH3与NaClO反应制得。
①请写出NH3的电子式:________________________
②肼溶于水显弱碱性,其原理与氨相似。请用电离方程式解释肼的水溶液显碱性的原因是:________
③请写出上述制备肼的化学方程式:______________________________________________________
【答案】SiO2 CH3CH(CH3)2 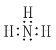 N2H4·H2O
N2H4·H2O![]() OH-+N2H
OH-+N2H![]() 2NH3+NaClO=NaCl+N2H4+H2O
2NH3+NaClO=NaCl+N2H4+H2O
【解析】
根据化合价升降法书写氧化还原方程式,运用类比的方法推测肼在水中呈碱性的原因,并写出相应的电离方程式。
(1)石英的主要成分的化学式是SiO2,异丁烷的结构简式为CH3CH(CH3)2;
(2)①NH3中N原子最外层有5个电子,其中3个为单电子,分别与3个H原子最外层的电子共用形成3个N-H共价键,故NH3的电子式为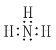 ;
;
②氨溶于水发生反应生成一水合氨,一水合氨在水中电离生成铵根离子和氢氧根离子,所以氨的水溶液呈碱性,由于肼的性质与氨相似,则肼也可以和水反应生成一水合肼,一水合肼可以电离出![]() 和OH-,则肼的水溶液呈碱性的原因用电离方程式解释为N2H4·H2O
和OH-,则肼的水溶液呈碱性的原因用电离方程式解释为N2H4·H2O![]() OH-+
OH-+![]() ;
;
③NH3可以与NaClO发生氧化还原反应,生成N2H4和NaCl,反应过程中NaClO中1个ClO-得到2个电子生成Cl-,NH3中1个N原子失去1个电子生成N2H4,根据得失电子守恒,2个NH3失去2个电子转移给NaClO才可以发生守恒,结合原子守恒,制备肼的化学方程式为2NH3+NaClO=NaCl+N2H4+H2O。