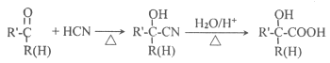
题目内容
【题目】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
物质 | CH3OH(l) | CO(g) | H2(g) |
燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为____________。
②图中反应达平衡时,K=_______(mol/L)-2;CO的平衡转化率为________________。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________。

若用该电池及惰性电极电解2L饱和和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合游学中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________。
【答案】CO(g)+2H2(g)=CH3OH(l) △H=-127.7kJ/mol 0.02mol/(Lmin) 9.375或![]() 60% CH3OH-6e-+H2O=CO2↑+6H+ 12 1:1800
60% CH3OH-6e-+H2O=CO2↑+6H+ 12 1:1800
【解析】
(1)先写出三个反应的热化学方程式,然后根据盖斯定律,将它们叠加,就可得到所需反应的热化学方程式;
(2)①根据V=![]() 计算化学反应速率;
计算化学反应速率;
②根据化学平衡常数K=![]() ,根据物质的转化率等于转化率与投入量的比值计算;
,根据物质的转化率等于转化率与投入量的比值计算;
(3)通入甲醇的电极为负极,失去电子,结合电解质溶液呈酸性书写电极反应式;先写出电解方程式,然后根据NaOH、Cl2的物质的量关系,结合溶液的体积计算pH;
(4)NaOH与HCOOH发生中和反应产生HCOONa和水,根据溶液的pH及HCOOH的电离平衡常数计算溶液中n(HCOOH):n(HCOONa)。
(1) ①CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol;
O2(g)=CO2(g) △H=-283.0kJ/mol;
②H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol;
O2(g)=H2O(l) △H=-285.8kJ/mol;
③CH3OH(l)+![]() O2(g)= CO2(g)+2H2O(l) △H=-726.8kJ/mol;
O2(g)= CO2(g)+2H2O(l) △H=-726.8kJ/mol;
①+2×②-③,整理可得:CO(g)+2H2(g)=CH3OH(l) △H=-127.7kJ/mol;
(2)①V=![]() =0.02mol/(Lmin);
=0.02mol/(Lmin);
②CO(g)+2H2(g)![]() CH3OH(l)
CH3OH(l)
根据化学方程式可得其化学平衡常数K==![]() =9.375;
=9.375;
CO的平衡转化率![]() =60%;
=60%;
(3)a电极通入甲醇,失去电子,发生氧化反应,由于是酸性环境,所以CH3OH失去电子变为CO2气体,电极反应式为CH3OH-6e-+H2O=CO2↑+6H+;用惰性电极电解NaCl饱和溶液的方程式为:2NaCl+H2O![]() 2NaOH+H2↑+Cl2↑,n(NaOH)=2n(Cl2)=2×
2NaOH+H2↑+Cl2↑,n(NaOH)=2n(Cl2)=2×![]() =0.02mol,c(NaOH)=
=0.02mol,c(NaOH)=![]() =0.01mol/L,c(H+)=
=0.01mol/L,c(H+)=![]() =10-12mol/L,所以溶液的pH=12;
=10-12mol/L,所以溶液的pH=12;
(4)HCOOH是一元弱酸,在溶液中存在电离平衡:HCOOH![]() HCOO-+H+,该反应的电离平衡常数K=
HCOO-+H+,该反应的电离平衡常数K=![]() =1.8×10-4,
=1.8×10-4,![]() =1.8×103,所以可得
=1.8×103,所以可得![]() =
=![]() 。
。